题目内容
【题目】盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A. 在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO![]() 和OH-
和OH-
B. NaHCO3溶液中:c (H+)+ c (H2CO3)=c(OH-)
C. 10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. 中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同
【答案】C
【解析】
A.在NaHCO3溶液中加入等物质的量的NaOH,反应后溶质为碳酸钠,碳酸根离子部分水解生成碳酸氢根离子,所以溶液中的阴离子有:CO32-、HCO3-、OH-,故A错误;
B.碳酸氢钠溶液中根据物料守恒知:c(Na+)=c (H2CO3)+c(HCO3-)+c(CO32-),根据电荷守恒知:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2 c(CO32-),所以c(H+)+c(H2CO3)=c(OH-)+c(CO32-),故B错误;
C.反应后生成醋酸钠,醋酸钠是强碱弱酸盐能水解,醋酸根离子水解导致钠离子浓度大于醋酸根离子浓度,溶液呈碱性,所以氢氧根离子浓度大于氢离子浓度,醋酸钠以电离为主水解为次,所以各种离子浓度关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+),所以C选项是正确的;
D.氯化氢是强电解质,醋酸是弱电解质,pH值相同的盐酸和醋酸,醋酸的浓度远远大于盐酸,所以等体积的盐酸和醋酸,醋酸的物质的量远远大于盐酸的物质的量,中和体积与pH都相同的HCl溶液和CH3COOH溶液,所消耗的NaOH醋酸的多,盐酸的少,故D错误。所以C选项是正确的。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】用下列装置不能达到实验目的的是( )
选项 | A. | B. | C. | D. |
装置 |
|
|
|
|
实验目的 | 验证氨极易溶于水 | 配制一定物质的量浓度的溶液试验中,为定容时的操作 | 实验室分离 CO 和 | 制备并用排气法收集 NO 气体 |
A.AB.BC.CD.D
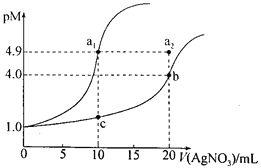
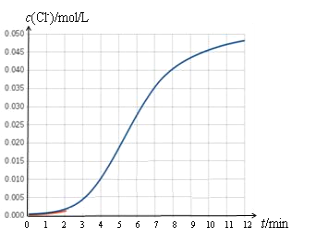
【题目】某化学兴趣小组欲测定 KClO3溶液与NaHSO3溶液反应的化学反应速率。所用试剂为10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液,所得数据如图所示。
已知:ClO3 + 3HSO3=Cl + 3SO42 + 3H+
(1)根据实验数据可知,该反应在0~4min的平均反应速率:v(Cl-)=_________mol/(L·min)。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小。某小组同学针对这一现象进一步通过测定 c(Cl-)随时间变化的曲线探究影响因素,具体如下表所示。
方案 | 假设 | 实验操作 |
I | 该反应放热,使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mol/LKClO3溶液和10mL0.3mol/LNaHSO3溶液, |
II | 取10mL0.1mol/LKClO3溶液加入烧杯中,向其中加入少量NaCl固体,再加入10mL0.3mol/LNaHSO3溶液。 | |
III | 溶液酸性增强加快了化学反应速率 | 分别向2只烧杯中加入10mL0.1mol/LKClO3溶液;向烧杯①中加入1 mL水,向烧杯②中加入1mL0.2mol/L 盐酸;再分别向2只烧杯中加入10mL0.3mol/LNaHSO3溶液。 |
①补全方案I中的实验操作:_____。
②方案II中的假设为_____。
③除I、II、III中的假设外,还可以提出的假设是_____。
④在已知方案 I 的假设不成立的情况下,某同学从控制变量的角度思考,认为方案III中实验操作设计不严谨,请进行改进:_____。
⑤反应后期,化学反应速率变慢的原因是_____。