题目内容
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
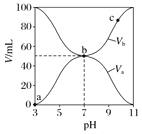
A. Ka=1×10-6
B. b点时,c(B+)=c(A-)
C. c点时,![]() 随温度升高而增大
随温度升高而增大
D. a→c过程中水的电离程度始终增大
【答案】B
【解析】
根据图知,0.1mol/L酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;0.1mol/L碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱;
A.由图可知 0.1molL-1HA 溶液pH=3,由 HAH++A-可知:Ka=![]() =
=![]() =10-5,故A错误;
=10-5,故A错误;
B.b点时,两者等体积混合溶液呈中性,所以离子浓度的大小为:c(B+)=c(A-)>c(H+)=c(OH-),故B正确;
C.c点时,A-的水解平衡常数Kh=[c(OH-)·c(HA)]/c(A-),升高温度Kh增大,则![]() 减小,故C错误;
减小,故C错误;
D.a→b是酸过量和b→c 是碱过量,酸、碱对水的电离平衡起抑制作用,可水解的盐对水的电离平衡起促进作用,b点是弱酸弱碱盐水解对水的电离起促进作用,所以a→c 过程中水的电离程度先增大后减小,故D错误。
故选B。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】下列“试剂”和“烧杯中的物质”不能完成“实验目的”的是
实验目的 | 试剂 | 烧杯中的物质 | |
A | 醋酸的酸性强于苯酚 | 碳酸氢钠溶液 | ①醋酸 ②苯酚溶液 |
B | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
C | 甲基对苯环的活性有影响 | 酸性高锰酸钾溶液 | ①苯 ②甲苯 |
D | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 | 金属钠 | ①水 ②乙醇 |
A. A B. B C. C D. D
【题目】现有部分短周期元素的性质或原子结构如表:
元素编号 | 元素性质或原子结构 |
T | M层上有6个电子 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟强碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_____。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式_____,如何检验某溶液中含该离子_____。
(3)元素Z在周期表中的位置_____,元素Z与元素T相比,非金属性较强的是_____(用元素符号表示),下列表述中能证明这一事实的是_____(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与氢氧化钠溶液反应