题目内容
【题目】绿矾(FeSO4·7H2O)可作人体补血剂。某同学欲测定补血剂中铁元素的含量,设计了如下实验步骤:

请回答下列问题:
(1)步骤②加入过量H2O2的目的是__。
(2)步骤③加入了足量氨水,反应的离子方程式为__。
(3)步骤④中一系列处理的操作步骤:过滤、__、干燥、灼烧、冷却、称量。
(4)若实验中铁无损耗,则每片补血剂中含铁元素的质量为__g。
(5)另一位同学认为用酸性KMnO4溶液滴定也能进行铁元素含量的测定,①写出酸性KMnO4溶液与Fe2+反应的离子方程式___。
②实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、玻璃棒、量筒、烧杯、胶头滴管外,还需__。
③上述实验中的KMnO4溶液需要进行酸化处理,可用于酸化的酸的化学式为__。
【答案】将Fe2+全部氧化为Fe3+ Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 洗涤 0.07a 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 250mL容量瓶 H2SO4
【解析】
测定补血剂中铁元素的含量,由实验流程可知,研细后加硫酸溶解,过滤分离出不溶性物质,滤液中含Fe2+,加过氧化氢发生反应:2Fe2++H2O2+2H+=2Fe3++2H2O,步骤③加入了足量氨水,发生反应:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+,步骤④中过滤、洗涤、干燥、灼烧、冷却、称量,ag为氧化铁的质量,由于Fe原子守恒可计算含量,酸性高锰酸钾具有强氧化性,可将Fe2+氧化为Fe3+,发生反应:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,配制一定物质的量浓度的KMnO4溶液250mL,一定要选250 mL容量瓶,因为高锰酸钾可氧化氯离子,硝酸具有氧化性均会干扰实验,只有选用硫酸进行酸化。
根据以上分析进行解答。
(1)步骤②加入过量H2O2的目的是将Fe2+全部氧化为Fe3+。
答案为:将Fe2+全部氧化为Fe3+。
(2) 步骤③加入了足量氨水,反应的离子方程式为Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。
答案为:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。
(3) 步骤④中一系列处理的操作步骤为:过滤、洗涤、干燥、灼烧、冷却、称量。
答案为:洗涤。
(4) ag为氧化铁的质量,若实验中铁无损耗,由Fe原子守恒可知,每片补血剂中含铁元素的质量为: 。
。
答案为:0.07a。
(5)①酸性高锰酸钾具有强氧化性,可将Fe2+氧化为Fe3+,发生反应:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
②配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、药匙、玻璃棒、量筒、烧杯、胶头滴管外,还需250 mL容量瓶。
答案为:250 mL容量瓶。
③因高锰酸钾可氧化氯离子,硝酸具有氧化性均会干扰实验,实验中的KMnO4溶液需要进行酸化处理,只有选用稀硫酸进行酸化。
答案为:H2SO4 。

【题目】三氯氧磷(POCl3)是一种工业化工原料,可用于制取有机磷农药、长效磺胺药物等,还可用作染料中间体、有机合成的氯化剂和催化剂、阻燃剂等。利用O2和PCl3为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
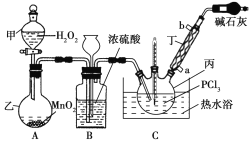
已知PCl3和三氯氧磷的性质如表:
熔点/℃ | 沸点/℃ | 其他物理或化学性质 | |
PCl3 | -112.0 | 76.0 | PCl3和POCl3互溶,均为无色液体,遇水均剧烈水解,发生复分解反应生成磷的含氧酸和HCl |
POCl3 | 1.25 | 106.0 |
(1)装置A中的分液漏斗能否用长颈漏斗代替?做出判断并分析原因:_______
(2)装置B的作用是______________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
(3)仪器丙的名称是___________,实验过程中仪器丁的进水口为__________(填“a”或“b”)口。
(4)写出装置C中发生反应的化学方程式_______,该装置中用温度计控制温度为60~65 ℃,原因是________。
(5)称取16.73 g POCl3样品,配制成100 mL溶液;取10.00 mL溶液于锥形瓶中,加入3.2 mol·L-1的AgNO3溶液10.00 mL,并往锥形瓶中滴入5滴Fe2(SO4)3溶液;用0.20 mol·L-1的KSCN溶液滴定,达到滴定终点时消耗KSCN溶液10.00 mL(已知:Ag++SCN-=AgSCN↓)。则加入Fe2(SO4)3溶液的作用是________,样品中POCl3的纯度为_____________。









