题目内容
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中Y原子的最外层电子数是其电子层数的3倍。下列说法正确的是( )
![]()
A.Y和Z的最高正化合价相同
B.气态氢化物的热稳定性:XH3<H2Y<H2Z
C.原子半径的大小:r(W)>r(Y)>r(Z)
D.W的最高价氧化物对应水化物的酸性比Z的强
【答案】D
【解析】
X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,次外层电子数为2,最外层电子数为6,则Y为O元素;由图中的位置可知,X为N,Z为S,W为Cl,然后利用元素周期律及物质的性质来解答。
A.Y为O元素,氧元素一般没有正化合价,故A错误;
B.X为N,Y为O,Z为S,非金属性越强,简单气态氢化物的稳定性越强,非金属性O>N>S,则气态氢化物的热稳定性: H2Y>XH3>H2Z,,故B错误
C.Y为O,Z为S,W为Cl,同周期元素从左到右,原子半径逐渐减小,则原子半径:r(W) <r(Y),故C错误;
D.W为Cl元素,最高价含氧酸HClO4是最强的含氧酸,故D正确;
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】将气体X通入溶液A(如下图,尾气吸收装置略)中,实验现象能够支持结论的是
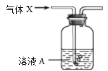
选项 | 气体X | 溶液A及反应现象 | 结论 |
A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
B. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
C. | 溴乙烷与氢氧化钠醇溶液共热生成的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生反应 |
D. | 碳酸钠固体与醋酸溶液反应产生的气体 | 苯酚钠溶液中出现白色沉淀 | 碳酸的酸性强于苯酚 |
A. A B. B C. C D. D