题目内容
【题目】某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)该配位化合物的化学式为________________________,配合物中采取sp3杂化的原子按第一电离能由大到小排列顺序为______________(用元素符号表示),1mol配离子中含有的σ键数目为_________________。
(2)D元素基态原子的最外层电子排布图为_______________________________。
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_________________________________。
(4)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,该分子中B元素的杂化方式为________。
(5)该配合物溶于水得深蓝色溶液,加入乙醇溶剂,将析出深蓝色的晶体,则加入乙醇的作用是____________________________________________________。
【答案】[Cu(NH3)4]SO4·H2O[或Cu(NH3)4SO4·H2O] N>O>S 16NA ![]() H2O2分子与H2O分子之间形成氢键(从相似相溶原理,分子结构相似的物质易互溶等角度回答,只要答案合理均可) H—N=N—H sp2 降低溶剂的极性,减小[Cu(NH3)4]SO4·H2O的溶解度
H2O2分子与H2O分子之间形成氢键(从相似相溶原理,分子结构相似的物质易互溶等角度回答,只要答案合理均可) H—N=N—H sp2 降低溶剂的极性,减小[Cu(NH3)4]SO4·H2O的溶解度
【解析】
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为14∶4∶5∶1∶1,其中C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-1)dn+6ns1,则n+6=10,故n=4,故其外围电子排布为3d104s1,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可以知道A为H、B为N,由原子数目之比,可以知道该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4·H2O,据此解答。
(1) C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素的外围电子排布为(n-1)dn+6ns1,则n+6=10,故n=4,故其外围电子排布为3d104s1,则E为Cu;故该深蓝色晶体应含有[Cu(NH3)4]2+、SO42-,结合原子序数可以知道A为H、B为N,由原子数目之比,可以知道该配合物含有1个结晶水,故其化学式为:[Cu(NH3)4]SO4·H2O;
同主族自上而下第一电离能减小,故O元素第一电离能大于S元素,O与N元素同周期,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能大于O元素,故第一电离能由大到小的排列顺序为:N>O>S;1mol配离子中含有的σ键数目为(4×3+4)NA=16 NA,
因此,本题正确答案是:[Cu(NH3)4]SO4·H2O;N>O>S;16 NA;
(2)D为S元素,其原子的最外层电子排布图为![]() ,
,
因此,本题正确答案是:![]() ;
;
(3) O元素可与H元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,则为H2O、H2O2,两种化合物可任意比互溶,其主要原因为:H2O与H2O2分子之间存在氢键,
因此,本题正确答案是:H2O2分子与H2O分子之间形成氢键;
(4)H元素与N元素可形成分子式为N2H2的化合物,该化合物的分子具有平面结构,N原子之间形成N=N双键,N原子与H原子之间形成N-H键,其结构式为H—N=N—H,该分子中N元素的杂化方式为sp2,
因此,本题正确答案是:H—N=N—H ;sp2 ;
(5) 向溶液中加入乙醇后会析出蓝色晶体,说明该配合物在乙醇中的溶解度小于在水中的溶解度,则加入乙醇的作用是降低溶剂的极性,减小[Cu(NH3)4]SO4·H2O的溶解度
因此,本题正确答案是:降低溶剂的极性,减小[Cu(NH3)4]SO4·H2O的溶解度。

 阅读快车系列答案
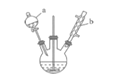
阅读快车系列答案【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。
已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子质量 | 溶解性 |
苯甲醛 | 178.1 | 1.04 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.04 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |
实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
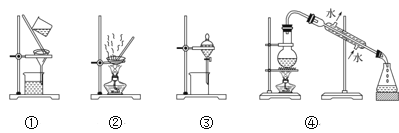
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。
(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。








