题目内容
7.3mol乙炔跟5mol氢气在密闭容器中反应,当其达到平衡时,生成amol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )| A. | 6mol | B. | 10mol | C. | 3amol | D. | 3mol |
分析 据元素守恒,反应后混合气体的耗氧量即是3molC2H2和5molH2的耗氧量,反应生成CO2和H2O,根据碳元素守恒有n(CO2)=2n(C2H2),根据氢元素守恒由n(H2O)=n(C2H2)+n(H2),根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O),据此计算消耗的氧气.
解答 解:反应前后C和H反应后元素的质量没有发生变化,则混合气体的耗氧量即是3molC2H4和5molH2的耗氧量,
根据碳元素守恒可知:n(CO2)=2n(C2H2)=6mol,
根据氢元素守恒可知:n(H2O)=n(C2H2)+n(H2)=3mol+5mol=8mol,
根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O)=12mol+8mol=20mol,
即n(O2)=$\frac{1}{2}$×20mol=10mol,
故选B.
点评 本题考查化学方程式有关计算,为高频考点,明确反应中各元素原子守恒是解本题关键,注意:消耗氧气的量与生成乙烯的多少无关,为易错点.

练习册系列答案
相关题目
17.工业上消除氮氧化物的污染可用如下反应:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如表.下列说法不正确的是( )
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
18.如图图示对应的实验操作均正确的是( )
| A. | 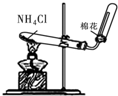 | B. |  | C. | 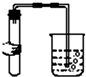 | D. | 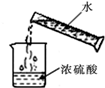 |
15.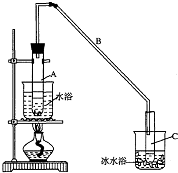 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
已知: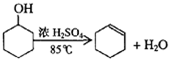
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,
缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静 置、分层,环己烯在上层,分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②实验制得的环己烯精品的质量往往低于理论产量,其可能的原因是c
a.蒸馏时从100℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
 某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯已知:

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
将12.5mL环己醇加入试管A中,再加入l mL浓硫酸,摇匀后放入碎瓷片,
缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是防止暴沸,导管B除了导气外还具有的作用是冷凝.
②试管C置于冰水浴中的目的是使环己烯液化,减少挥发.
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静 置、分层,环己烯在上层,分液后用c (填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②实验制得的环己烯精品的质量往往低于理论产量,其可能的原因是c
a.蒸馏时从100℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是bc.a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点.
19.下列说法正确的是( )
| A. | 常温下pH=4的溶液中,Na+、SiO32-、SO42-、K+可以大量共存 | |
| B. | 对滴有酚酞的碳酸钠溶液微热,溶液颜色加深 | |
| C. | 乙醇和乙酸都能溶于水,都是电解质 | |
| D. | 室温下,某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
16.下列物质不能溶于Al(OH)3的是( )
| A. | 氨水 | B. | 稀硫酸 | C. | 氢氧化钠溶液 | D. | 浓盐酸 |
 .
.