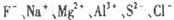题目内容
处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列关于A、B、C、D四种元素的说法中,正确的是
A.元素的非金属性依次增强 B.元素的电负性依次减小
C.元素的第一电离能依次增大 D.最高价氧化物对应水化物的酸性依次减弱
BD
解析试题分析:同周期元素气态原子获得一个电子所放出的能量A>B>C>D,说明金属性A<B<C<D,同周期元素从左到右元素的金属性逐渐降低,则原子序数A>B>C>D,则A、同周期元素原子序数A>B>C>D,元素的非金属性依次减弱,故A错误;B、同周期元素原子序数A>B>C>D,同周期元素从左到右元素的电负性依次减小,故B正确;C、由气态原子获得一个电子所放出的能量A>B>C>D可知由元素的第一电离能依次减小,故C错误;D、同周期元素原子序数A>B>C>D,同周期元素从左到右元素非金属性逐渐增强,对应最高价氧化物对应水化物的酸性依次增强,则A、B、C、D最高价氧化物对应水化物的酸性依次减弱,故D正确,答案选BD。
考点:考查元素周期表和元素周期律的应用

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
| A.X、Y、Z、W的原子半径依次减小 |
| B.W与X形成的化合物中只含离子键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
运用元素周期律分析下面的推断,其中错误的是( )
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
运用元素周期律分析下列推断,其中错误的是
| A.铍是一种轻金属,它的氧化物的水化物可能具有两性 |
| B.砹单质是一种有色固体,砹化氢很不稳定 |
| C.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
| D.硫酸锶难溶于水 |
X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的一种核素的质量数为14,中子数为8 |
| Y | Y与X同周期,且它的一种氧化物只能用排水法收集 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的原子核外电子总数是其电子层数的4倍 |
A.原子半径:W> X>Y,离子半径:W>Z
B.氧化物对应的水化物的酸性:Z> Y>X
C.Y的最高正价含氧酸,可由它的氢化物为原料来制取
D.W的单质与X的一种氧化物不能发生置换反应
W、X、Y、Z是短周期元素,其部分性质如下表
下列说法正确的是
| A.气态氢化物的热稳定性:X>W | B.最高价氧化物对应水化物的酸性:Y>X |
| C.离子半径:Z>W | D.Z的氧化物中含有非极性共价键 |
元素的性质随着元素原子序数的递增而呈周期性变化的原因是
| A.元素原子的核外电子排布呈周期性变化 |
| B.元素的原子半径呈周期性变化 |
| C.元素的化合价呈周期性变化 |
| D.元素的金属性、非金属性呈周期性变化 |
根据原子结构及元素周期律的知识,下列推断正确的是
| A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl?、S2?、Ca2+、K+半径逐渐减小 |
D.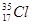 与 与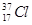 得电子能力相同 得电子能力相同 |