题目内容
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性。下列说法正确的是( )
| A.X、Y、Z、W的原子半径依次减小 |
| B.W与X形成的化合物中只含离子键 |
| C.W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D.若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3 |
A
解析试题分析:W、X、Y、Z为短周期元素,W、Z同主族,W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,故W、Z为非金属,原子序数Z>W,W处于第二周期,Z处于第三周期,X、Y、Z同周期,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,则原子序数Y>X,且二者处于第三周期,X、Y、Z的原子序数Z>Y>X。W、Z同主族,原子序数Z>W,X、Y、Z同周期,X、Y、Z的原子序数Z>Y>X,所以原子半径X>Y>Z>W,故A正确;若W与X形成的化合物为过氧化钠,既含离子键又含共价键,故B错误;W的气态氢化物为氨气、水、氟化氢时,分子间存在氢键,沸点高于同族其它氢化物的沸点,故C错误;若W为N元素,Y为Mg元素,二者的原子序数相差5,二者形成化合物的化学式可能为Mg3N2,为Y3W2,故D错误。
考点:考查位置结构性质的相互关系应用等相关知识。

已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
| A.质子数c>b | B.离子还原性Y2->Z- |
| C.氢化物稳定性H2Y>HZ | D.原子半径X<W |
下列化学用语中,不正确的是
A.氯原子结构示意图:  | B.HCl的电子式: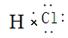 |
| C.H2O分子的结构式:H-O-H | D.乙炔的比例模型: 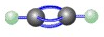 |
下列中各组性质的比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②离子还原性:S2->Cl->Br ->I- ③沸点:HF>HCl>HBr>HI
④金属性:K>Na>Mg>Al ⑤气态氢化物稳定性:HF>HCl>H2S ⑥半径:O2->Na+>Na>Cl
| A.①②③ | B.②③④ | C.①④⑤ | D.①②③④⑤⑥ |
下图是元素周期表前四周期的一部分,关于元素R、W、X、Y、Z的叙述正确的是( )
| A.最高价氧化物的水化物的酸性:W>Y |
| B.Z的单质常温下是液体,所在的周期中含有32种元素 |
| C.Z的原子序数比R大17 |
| D.氢化物的沸点:X<Z |
X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
| A.原子序数: X<Y | B.原子半径:X<Y |
| C.离子半径:X>Y | D.原子最外层电子数:X<Y |
现有四种元素的基态原子的电子排布式如下:① [Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
| A.最高正化合价:③>②>① | B.第一电离能:③>②>① |
| C.电负性:③>②>① | D.原子半径:③>②>① |