题目内容
根据原子结构及元素周期律的知识,下列推断正确的是
| A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl?、S2?、Ca2+、K+半径逐渐减小 |
D.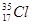 与 与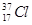 得电子能力相同 得电子能力相同 |
D
解析试题分析:A、没有指明最高价含氧酸,错误;B、核外电子排布相同的微粒可以是分子、原子或粒子,如O2?、H2O、HF、Ne、Na+、Mg2+等化学性质不相同,错误;C、S2?半径大于Cl?,错误;D、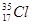 与
与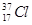 都是Cl原子,得电子能力相同,正确。
都是Cl原子,得电子能力相同,正确。
考点:本题考查元素周期律、结构与性质。

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.气态氢化物的热稳定性:H2T>H2R
C.M与T形成的化合物能溶于氨水溶液
D.相同条件下,单质与同浓度稀盐酸反应的速率:M>L
下列各组比较不正确的是 ( )
| A.锂与水反应不如钠与水反应剧烈 |
| B.还原性:K>Na>Li,故 |
| C.容沸点:Li>Na>K |
| D.原子半径:Li<Na<K |
以下是1-18号元素某性质的递变规律,Y轴代表的是 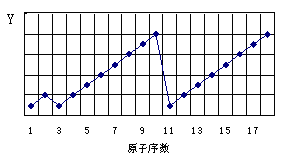
| A.原子半径 | B.金属性 | C.非金属性 | D.最外层电子数 |
下列叙述中正确的是
| A.卤素单质与水反应均可用X2+H2O===HXO+HX表示 |
| B.从F2到I2,卤素单质的颜色随着相对分子质量的增大而加深 |
| C.熔、沸点:Li>Na>K |
| D.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠 |
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |
以下有关原予结构及元素周期律的叙述正确的是
| A.同主族元素从上到下,单质的熔点逐渐降低 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |