题目内容
W、X、Y、Z是短周期元素,其部分性质如下表
下列说法正确的是
| A.气态氢化物的热稳定性:X>W | B.最高价氧化物对应水化物的酸性:Y>X |
| C.离子半径:Z>W | D.Z的氧化物中含有非极性共价键 |
B
解析试题分析:由元素的性质判断,W是S元素;X是Si元素;Y若是2层电子,则最外层电子数是4,Y是C元素,若Y是3层电子,则最外层电子数超过8个,不符合电子排布规律。Z是第三周期原子半径最小的金属元素,所以Z是Al。A、S的非金属性强于Si所以气态氢化物的稳定性:W>X,错误;B、C的非金属性强于Si,所以碳酸酸性强于硅酸,最高价氧化物对应水化物的酸性:Y>X,周期;C、铝离子有2层电子,硫离子有3层电子,所以硫离子半径大于铝离子半径,W>Z,错误;D、氧化铝是离子化合物,不含有共价键,错误,答案选B。
考点:考查元素性质与元素的对应关系的判断,元素周期律的应用

下图是元素周期表前四周期的一部分,关于元素R、W、X、Y、Z的叙述正确的是( )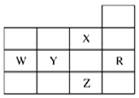
| A.最高价氧化物的水化物的酸性:W>Y |
| B.Z的单质常温下是液体,所在的周期中含有32种元素 |
| C.Z的原子序数比R大17 |
| D.氢化物的沸点:X<Z |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是 ( )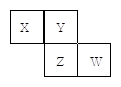
| A.原子半径:W> Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.4种元素的单质中,Z单质的熔、沸点最低 |
| D.W单质能与水反应,生成一种具有漂白性的物质 |
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,其中X原子最外层电子数是其电子层数的2倍。下列说法正确的是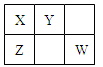
| A.四种元素的原子半径大小rY>rW>rX>rZ |
| B.元素X的含氧酸只有一种,元素Y则有两种 |
| C.元素Z的气态氢化物的稳定性比元素Y的强 |
| D.元素Y和W的氧化物是导致酸雨的主要原因 |
短周期元素X、Y、Z原子序数之和为28,X+与Z2-具有相同的核外电子层结构,Y、Z在同一周期。下列推测正确的是
| A.元素Y的最高化合价为+7 |
| B.三种元素的原子半径rZ>rY>rX |
| C.Z的单质比Y的单质更易与H2反应 |
| D.化合物X2Z2中阴阳离子数之比为1: 2 |
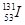 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中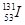 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关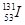 的叙述中错误的是( )
的叙述中错误的是( )
A.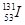 的化学性质与 的化学性质与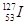 相同 相同 | B.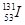 的原子序数为53 的原子序数为53 |
C.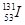 的原子核外电子数为78 的原子核外电子数为78 | D.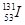 的原子核内中子数多于质子数 的原子核内中子数多于质子数 |
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,下列叙述正确的是
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
B.气态氢化物的热稳定性:H2T>H2R
C.M与T形成的化合物能溶于氨水溶液
D.相同条件下,单质与同浓度稀盐酸反应的速率:M>L
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |