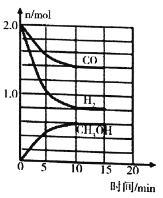
题目内容
【题目】外观与氯化钠相似的亚硝酸钠(Na2NO2)在生活中应用十分广泛,如可用作建筑钢材缓蚀剂、肉制品发色剂等。已知:2NO+Na2O2=2NaNO2 2NO2+Na2O2=2NaNO3
I.某学习小组设计如图装置制备亚硝酸钠(夹持装置已省略)
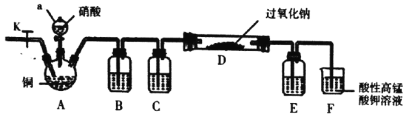
(1)仪器a的名称为________。
(2)装置B、C、E中的试制可选择___。
A 水、浓硫酸、浓硫酸
B 氢氧化钠溶液、浓硫酸、浓硫酸
C 酸性高锰酸钾溶液、浓硫酸、氢氧化钠溶液
D 水、浓硫酸、氢氧化钠溶液
(3)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡,该操作的目的是________。
(4)装置D中的实验现象是________。
(5)装置F中发生反应的离子方程式为________。
Ⅱ.工业上可以用烧碱溶液吸收硝酸厂的尾气制得亚硝酸钠。某学习小组设计如下实验方案测定该产品中亚硝酸钠的质量分数。取1.500g产品配成250mL溶液,取25.00mL溶液于锥形瓶中加入过量的稀硫酸和碘化钾溶液充分反应后,加入适当的指示剂,用0.1000mol/L Na2S2O3标准溶液进行滴定,记录数据如下表。
实验序号 | 1 | 2 | 3 |
Na2S2O3标准溶液体积/mL | 20.02 | 19.98 | 20.00 |
已知: 2NaNO2+2KI+2H2SO4 =2NO↑+I2+2H2O+Na2SO4+K2SO4 2Na2S2O3+I2=Na2S4O6+2NaI
(6)合适的指示剂是________
(7)该产品的纯度为________。
(8)经过讨论,同学认为该产品中可能含有硝酸钠,它会使测定结果________(填“偏高”、“偏低”、“无影响”) 。
【答案】分液漏斗 A 排尽装置内的空气,防止过氧化钠或NO与其反应 淡黄色固体变成白色 5 NO+3MnO4—+4H+=5NO3—+3Mn2++2H2O 淀粉 92.00% 偏高
【解析】
I.A中铜与稀硝酸反应制取NO,获得一氧化氮所用的硝酸具有挥发性,这样会干扰实验结果,B装置是除去酸性气体,水也能与过氧化钠反应,装置C的作用是干燥NO,E是防止F中的水蒸气进入D中,D中NO能将过氧化钠还原,F中高锰酸钾具有氧化性,能将一氧化氮氧化。
Ⅱ.亚硝酸钠将碘离子氧化,生成碘单质,用硫代硫酸钠滴定,可用淀粉作指示剂,根据关系式2NaNO2~I2~2Na2S2O3计算出亚硝酸钠的含量,硝酸钠也能将碘氧化,使测定值偏大。
I.(1)仪器a的名称为分液漏斗。
(2)获得一氧化氮所用的硝酸具有挥发性,这样会干扰实验结果,B装置是除去酸性气体,水也能与过氧化钠反应,装置C的作用是干燥NO,E是防止F中的水蒸气进入D中,装置B、C、E中的试制可选择水、浓硫酸、浓硫酸;
故选A;
(3)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡,该操作的目的是排尽装置内的空气,防止过氧化钠或NO与其反应。
(4)NO能将过氧化钠还原,装置D中的实验现象是淡黄色固体变成白色。
(5)高锰酸钾具有氧化性,能将一氧化氮氧化,装置F中发生反应的离子方程式为5 NO+3MnO4—+4H+=5NO3—+3Mn2++2H2O。
Ⅱ.(6)亚硝酸钠将碘离子氧化,生成碘单质,用硫代硫酸钠滴定,可用淀粉作指示剂,(7)2NaNO2+2KI+2H2SO4 =2NO↑+I2+2H2O+Na2SO4+K2SO4, 2Na2S2O3+I2=Na2S4O6+2NaI,
得关系式:2NaNO2~I2~2Na2S2O3,
n(NaNO2)=n(Na2S2O3)=0.1000mol/L×![]() =0.02mol,
=0.02mol,
该产品的纯度为=![]() ×100%= 92.00%;
×100%= 92.00%;
(8)硝酸钠也能将碘氧化,使测定值偏高。

 阅读快车系列答案
阅读快车系列答案