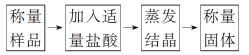
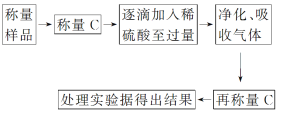
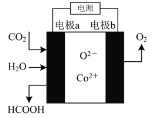
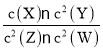题目内容
【题目】生产自来水的流程如图所示:回答下列问题.
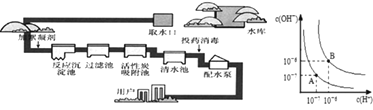
![]() 是常用的絮凝剂,它在水中最终生成 ______ 沉淀
是常用的絮凝剂,它在水中最终生成 ______ 沉淀![]() 填化学式
填化学式![]() .
.
![]() 天然水中含有较多的钙、镁离子,称为硬水.生活中常用 ______ 方法来降低水的硬度.
天然水中含有较多的钙、镁离子,称为硬水.生活中常用 ______ 方法来降低水的硬度.
![]() 过滤池利用了实验室过滤原理,在实验室过滤操作所用到的玻璃仪器是 ______ .
过滤池利用了实验室过滤原理,在实验室过滤操作所用到的玻璃仪器是 ______ .
![]() “投药消毒”中的“药”指漂白粉,请写出制取漂白粉的化学方程式 ______ .
“投药消毒”中的“药”指漂白粉,请写出制取漂白粉的化学方程式 ______ .
![]() 水的电离平衡曲线如图所示,若A点表示
水的电离平衡曲线如图所示,若A点表示![]() 时水的电离达平衡时的离子浓度,B点表示
时水的电离达平衡时的离子浓度,B点表示![]() 时水的电离达平衡时的离子浓度.
时水的电离达平衡时的离子浓度.
![]() 时
时![]() 的NaOH溶液中,由水电离出的
的NaOH溶液中,由水电离出的![]() ______
______ ![]() ,
,![]() ______
______ ![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() .
.
![]() 时,向含100ml水的烧杯中逐渐加入一定量的冰醋酸,下列叙述正确的有 ______
时,向含100ml水的烧杯中逐渐加入一定量的冰醋酸,下列叙述正确的有 ______ ![]() 填字母
填字母![]() .
.
A.溶液中一直存在:![]()
B.加入过程中,水的电离程度逐渐减小,醋酸的电离程度逐渐增大
C.加入过程中,溶液中所有离子浓度逐渐增大
D.加完冰醋酸后,若升高烧杯温度,溶液pH值降低
E.用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,最好选用甲基橙作指示剂.
【答案】![]() 煮沸 漏斗、烧杯、玻璃棒
煮沸 漏斗、烧杯、玻璃棒 ![]()
![]()
![]() AD
AD
【解析】
![]() 亚铁离子易被氧化为铁离子记性解答;
亚铁离子易被氧化为铁离子记性解答;![]() 加热煮沸能使钙、镁离子转化为沉淀;
加热煮沸能使钙、镁离子转化为沉淀;![]() 根据过滤的操作分析;
根据过滤的操作分析;![]() 氯气与石灰乳反应生成漂白粉;
氯气与石灰乳反应生成漂白粉;![]() 根据图2计算
根据图2计算![]() 时Kw,再计算水电离出的
时Kw,再计算水电离出的![]() ;水的电离是吸热过程;
;水的电离是吸热过程;![]() 溶液中存在电荷守恒;B.醋酸的浓度越大,其电离程度越小;C.溶液中氢离子浓度增大,氢氧根离子浓度减小;D.升高温度促进醋酸的电离;E.NaOH与醋酸溶液反应后生成醋酸钠,醋酸钠溶液为碱性,选用碱性条件下变色的指示剂。
溶液中存在电荷守恒;B.醋酸的浓度越大,其电离程度越小;C.溶液中氢离子浓度增大,氢氧根离子浓度减小;D.升高温度促进醋酸的电离;E.NaOH与醋酸溶液反应后生成醋酸钠,醋酸钠溶液为碱性,选用碱性条件下变色的指示剂。
![]() 是常用的絮凝剂,它在水中电离出亚铁离子易被氧化为铁离子,最终生成
是常用的絮凝剂,它在水中电离出亚铁离子易被氧化为铁离子,最终生成![]() ,故答案为:
,故答案为:![]() ;
;
![]() 天然水中含有较多的钙、镁离子,称为硬水,加热煮沸能使钙、镁离子转化为碳酸钙、氢氧化镁沉淀,从而降低水的硬度,故答案为:煮沸;
天然水中含有较多的钙、镁离子,称为硬水,加热煮沸能使钙、镁离子转化为碳酸钙、氢氧化镁沉淀,从而降低水的硬度,故答案为:煮沸;
![]() 过滤时用玻璃棒引流,用烧杯盛放滤液,漏斗为过滤器,所以用到的玻璃仪器有漏斗、烧杯、玻璃棒; 故答案为:漏斗、烧杯、玻璃棒;
过滤时用玻璃棒引流,用烧杯盛放滤液,漏斗为过滤器,所以用到的玻璃仪器有漏斗、烧杯、玻璃棒; 故答案为:漏斗、烧杯、玻璃棒;
![]() 氯气与石灰乳反应生成漂白粉,其反应的方程式为:
氯气与石灰乳反应生成漂白粉,其反应的方程式为:![]() ; 故答案为:
; 故答案为:![]() ;
;
![]() 由图2可知,
由图2可知,![]() 时
时![]() ,
,![]() 的NaOH溶液中,由水电离出的
的NaOH溶液中,由水电离出的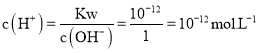 ;水的电离是吸热过程,温度越高水的电离程度越大,Kw越大,所以
;水的电离是吸热过程,温度越高水的电离程度越大,Kw越大,所以![]() ; 故答案为:
; 故答案为:![]() ;
;![]() ;
;
![]() 溶液中存在电荷守恒,即溶液中一直存在:
溶液中存在电荷守恒,即溶液中一直存在:![]() ,故A正确;
,故A正确;
B.加入过程中,醋酸的浓度越大,其电离程度越小,所以醋酸的电离程度逐渐减小,氢离子浓度增大,水的电离程度减小,故B错误;
C.溶液中![]() 为常数,氢离子浓度增大,则氢氧根离子浓度减小,故C错误;
为常数,氢离子浓度增大,则氢氧根离子浓度减小,故C错误;
D.升高温度促进醋酸的电离,所以加完冰醋酸后,若升高烧杯温度,醋酸电离出的氢离子浓度增大,则溶液pH值降低,故D正确;
E.用已知浓度的NaOH溶液滴定烧杯中的醋酸溶液,测定其浓度,NaOH与醋酸反应后生成醋酸钠,醋酸钠溶液为碱性,选用碱性条件下变色的指示剂,所以应该选用酚酞作指示剂;故E错误。 故答案为:AD.

【题目】
Ⅰ. 1)请对下列有机物进行分类,把正确答案(编号)填写在表格对应类别中
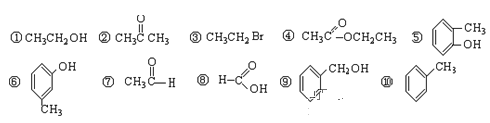
芳香烃 | 卤代烃 | 醇 | 酚 | 醛 | 酮 | 羧酸 | 酯 |
______ | ______ | ______ | ______ | ______ | ______ | ______ | ______ |
2)上述10种物质中,互为位置异构体的是(填写编号)______________________。
Ⅱ.用系统命名法写出下列烃的名称:
1)(CH3)2CHCH=CHCH(C2H5)CH2CH3 ______________________
2)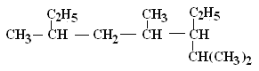 ______________________
______________________
Ⅲ. 物质A的系统命名为“1-丁烯”,其结构简式为____,请写出与该化合物含有相同官能团的所有其他同分异构体的结构简式及对应名称。_________________________
【题目】外观与氯化钠相似的亚硝酸钠(Na2NO2)在生活中应用十分广泛,如可用作建筑钢材缓蚀剂、肉制品发色剂等。已知:2NO+Na2O2=2NaNO2 2NO2+Na2O2=2NaNO3
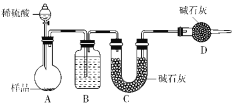
I.某学习小组设计如图装置制备亚硝酸钠(夹持装置已省略)
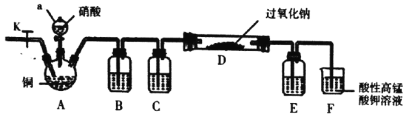
(1)仪器a的名称为________。
(2)装置B、C、E中的试制可选择___。
A 水、浓硫酸、浓硫酸
B 氢氧化钠溶液、浓硫酸、浓硫酸
C 酸性高锰酸钾溶液、浓硫酸、氢氧化钠溶液
D 水、浓硫酸、氢氧化钠溶液
(3)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡,该操作的目的是________。
(4)装置D中的实验现象是________。
(5)装置F中发生反应的离子方程式为________。
Ⅱ.工业上可以用烧碱溶液吸收硝酸厂的尾气制得亚硝酸钠。某学习小组设计如下实验方案测定该产品中亚硝酸钠的质量分数。取1.500g产品配成250mL溶液,取25.00mL溶液于锥形瓶中加入过量的稀硫酸和碘化钾溶液充分反应后,加入适当的指示剂,用0.1000mol/L Na2S2O3标准溶液进行滴定,记录数据如下表。
实验序号 | 1 | 2 | 3 |
Na2S2O3标准溶液体积/mL | 20.02 | 19.98 | 20.00 |
已知: 2NaNO2+2KI+2H2SO4 =2NO↑+I2+2H2O+Na2SO4+K2SO4 2Na2S2O3+I2=Na2S4O6+2NaI
(6)合适的指示剂是________
(7)该产品的纯度为________。
(8)经过讨论,同学认为该产品中可能含有硝酸钠,它会使测定结果________(填“偏高”、“偏低”、“无影响”) 。