题目内容
用“>”或“<”回答下列问题:
(1)酸性:H2CO3 H2SiO3,H2SiO3 H3PO4
(2)碱性:Ca(OH)2 Mg(OH)2,Mg(OH)2 Al(OH)3
(3)气态氢化物稳定性:H2O H2S,H2S HCl
(4)还原性:H2O H2S,H2S HCl
(5)酸性:H2SO4 H2SO3,HClO4 HClO
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高氧化物水化物的酸性越 ;
②元素的金属性越强,其对应最高氧化物水化物的碱性越 ;
③元素的 性越强,其对应气态氢化物的稳定性越 ;
④非金属性越强的元素生成的气态氢化物,其还原性越 ;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越 .
(1)酸性:H2CO3
(2)碱性:Ca(OH)2
(3)气态氢化物稳定性:H2O
(4)还原性:H2O
(5)酸性:H2SO4
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高氧化物水化物的酸性越
②元素的金属性越强,其对应最高氧化物水化物的碱性越
③元素的
④非金属性越强的元素生成的气态氢化物,其还原性越
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越
考点:元素周期律和元素周期表的综合应用,元素周期律的作用
专题:元素周期律与元素周期表专题
分析:①元素的非金属性越强,其对应最高氧化物水化物的酸性越强;
②元素的金属性越强,其对应最高氧化物水化物的碱性越强;
③元素的非金属性越强,其对应气态氢化物的稳定性越强;
④非金属性越强的元素生成的气态氢化物,其还原性越弱;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越强,结合元素的位置及金属性、非金属性比较来解答.
②元素的金属性越强,其对应最高氧化物水化物的碱性越强;
③元素的非金属性越强,其对应气态氢化物的稳定性越强;
④非金属性越强的元素生成的气态氢化物,其还原性越弱;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越强,结合元素的位置及金属性、非金属性比较来解答.
解答:
解:(1)非金属性C>Si,P>Si,则酸性为H2CO3>H2SiO3,H2SiO3<H3PO4,故答案为:>;<;
(2)金属性Ca>Mg>Al,则碱性为Ca(OH)2>Mg(OH)2,Mg(OH)2>Al(OH)3,故答案为:>;>;
(3)非金属性O>S,Cl>S,则气态氢化物稳定性为H2O>H2S,H2S<HCl,故答案为:>;<;
(4)非金属性O>S,Cl>S,则还原性为H2O<H2S,H2S>HCl,故答案为:<;>;
(5)S、Cl的最高价含氧酸均为强酸,而低价含氧酸为弱酸,则酸性为H2SO4>H2SO3,HClO4>HClO,故答案为:>;>;
从以上答案中可以归纳出:①元素的非金属性越强,其对应最高氧化物水化物的酸性越强,故答案为:强;
②元素的金属性越强,其对应最高氧化物水化物的碱性越强,故答案为:强;
③元素的非金属性越强,其对应气态氢化物的稳定性越强,故答案为:非金属;强;
④非金属性越强的元素生成的气态氢化物,其还原性越弱,故答案为:弱;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越强,故答案为:强.
(2)金属性Ca>Mg>Al,则碱性为Ca(OH)2>Mg(OH)2,Mg(OH)2>Al(OH)3,故答案为:>;>;
(3)非金属性O>S,Cl>S,则气态氢化物稳定性为H2O>H2S,H2S<HCl,故答案为:>;<;
(4)非金属性O>S,Cl>S,则还原性为H2O<H2S,H2S>HCl,故答案为:<;>;
(5)S、Cl的最高价含氧酸均为强酸,而低价含氧酸为弱酸,则酸性为H2SO4>H2SO3,HClO4>HClO,故答案为:>;>;
从以上答案中可以归纳出:①元素的非金属性越强,其对应最高氧化物水化物的酸性越强,故答案为:强;
②元素的金属性越强,其对应最高氧化物水化物的碱性越强,故答案为:强;
③元素的非金属性越强,其对应气态氢化物的稳定性越强,故答案为:非金属;强;
④非金属性越强的元素生成的气态氢化物,其还原性越弱,故答案为:弱;
⑤同种非金属元素形成的含氧酸,其成酸元素价态越高,其酸性也越强,故答案为:强.
点评:本题考查元素周期表和元素周期律的综合应用,为高频考点,把握同周期、同主族元素金属性、非金属性的比较为解答的关键,侧重学生分析、归纳能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
下列物质中,属于合金的是( )
| A、金 | B、不锈钢 | C、金属铝 | D、铜 |
在100mL某混合酸中,c(HNO3)=0.4mol?L-1,c(H2SO4)=0.1mol?L-1,向其中加入1.92g铜粉,待充分反应后,忽略溶液体积的变化,溶液中Cu2+的物质的量浓度为( )
| A、0.15 mol?L-1 |
| B、0.30 mol?L-1 |
| C、0.225 mol?L-1 |
| D、无法计算 |
现有X、Y、Z、W、Q五种短周期元素,原子序数依次增大,Y、Z、W、Q形成的简单离子具有相同的电子层结构,YX3、X2Z、X2Z2、W2Z、W2Z2都是常见的化合物,其中,YX3在常温下呈气态,能使酚酞溶液变红色.下列有关推断正确的是( )
| A、简单离子半径:Y>Z>W>Q>X |
| B、W2Z2与X2Z反应中氧化剂与还原剂物质的量之比为1:2 |
| C、X能分别与Y、Z、W形成共价化合物 |
| D、Y、W、Q的最高价氧化物对应的水化物两两之间一定相互反应 |
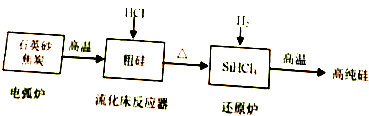 硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题:
硅在地壳中的含量较高.硅及其化合物的开发由来已久,在现代生活中有广泛应用,回答下列问题: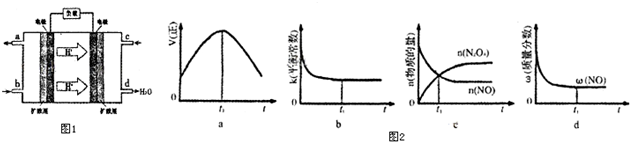
 某同学欲探究Cl2、Br2、I2之间的变化:
某同学欲探究Cl2、Br2、I2之间的变化: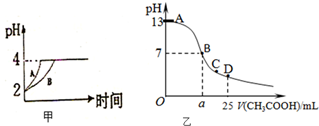 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题: