题目内容
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的Cq、Sq和Noxo
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.
①已知在常温常压下:
2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
H2O(g)═H2O(l)△H=-44.0kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
②以甲醇和氧气反应制成的燃料电池如图1所示,该电池工作过程中O2应从 (填“c”或“b”)口通入,电池负极反应式为 .
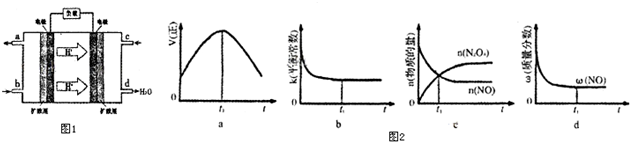
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.1mol?L-1 NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是 .
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)═N2O3(g),△H<0若该反应在绝热、恒容的密闭体系中进行,图2示意图能说明tl时刻达到平衡状态的是 .
(3)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)= ,若继续通入0.20mol SO2和0.1mol O2,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”).
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染.25℃时,将NH3溶于水得100mL 0.1mol?L-1的氨水,测得pH=11,则该条件下NH3?H2O的电离平衡常数约为 .
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.
①已知在常温常压下:
2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
H2O(g)═H2O(l)△H=-44.0kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
②以甲醇和氧气反应制成的燃料电池如图1所示,该电池工作过程中O2应从

③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.1mol?L-1 NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)═N2O3(g),△H<0若该反应在绝热、恒容的密闭体系中进行,图2示意图能说明tl时刻达到平衡状态的是
(3)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则v(O2)=
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染.25℃时,将NH3溶于水得100mL 0.1mol?L-1的氨水,测得pH=11,则该条件下NH3?H2O的电离平衡常数约为
考点:热化学方程式,化学电源新型电池,化学平衡常数的含义,化学平衡的影响因素,化学平衡状态的判断,离子浓度大小的比较
专题:基本概念与基本理论
分析:(1)①依据热化学方程式和 盖斯定律计算所需热化学方程式;
②依据原电池图示可知氢离子移向电极为正极,氧气应从正极通入,负极是甲醇燃料失电子在酸性环境中生成二氧化碳;
③将甲醇燃烧生成的足量CO2通入到浓度为0.1mol?L-1 NaOH溶液中,所得溶液的pH=8,判断市场的是碳酸氢钠溶液,依据碳酸氢钠溶液中离子浓度大小分析比较;
(2)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;当反应前后改变的物理量不变时,该可逆反应达到平衡状态;
(3)化学反应速率的定义求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向;
(4)根据氨水电离生成等量的铵根离子和氢氧根离子,求出平衡时各离子的浓度,在利用电离度、电离平衡常数的公式求解;
②依据原电池图示可知氢离子移向电极为正极,氧气应从正极通入,负极是甲醇燃料失电子在酸性环境中生成二氧化碳;
③将甲醇燃烧生成的足量CO2通入到浓度为0.1mol?L-1 NaOH溶液中,所得溶液的pH=8,判断市场的是碳酸氢钠溶液,依据碳酸氢钠溶液中离子浓度大小分析比较;
(2)可逆反应达到平衡状态,一定满足正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;当反应前后改变的物理量不变时,该可逆反应达到平衡状态;
(3)化学反应速率的定义求出氧气的速率;根据影响化学平衡的因素来判断平衡移动方向;
(4)根据氨水电离生成等量的铵根离子和氢氧根离子,求出平衡时各离子的浓度,在利用电离度、电离平衡常数的公式求解;
解答:
解:(1)①a、2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
b、2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
c、H2O(g)═H2O(l)△H=-44.0kJ/mol
依据盖斯定律计算a-b+c×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
②依据原电池图示可知氢离子移向电极为正极,氧气应从正极通入,c口是氧气通入的一端,负极是甲醇燃料失电子在酸性环境中生成二氧化碳,电极反应为:CH3OH-6e-+H2O=CO2+6H+;
故答案为:c,CH3OH-6e-+H2O=CO2+6H+;
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.1mol?L-1 NaOH溶液中,所得溶液的pH=8,判断溶液在为碳酸氢钠,碳酸氢根离子水解溶液呈碱性,溶液中离子浓度由大到小的顺序是:c(Na+)>C(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>C(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)NO(g)+NO2(g)═N2O3(g),△H<0,若该反应在绝热、恒容的密闭体系中进行,是气体体积减小的放热反应;
a、t1时正反应速率仍然在变化,说明没有达到平衡状态,故a错误;
b、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故b正确;
c、t1时三氧化二氮和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故c错误;
d、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故d正确;
故选bd;
(3)当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2+O2?2SO3
1 2
x 0.18mol
x=0.09mol
v(O2)=
=0.036mol.L-1?min-1;
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
故答案为:0.036mol.L-1?min-1;向正反应方向移动;
(4)氨水溶液pH=11,则C(H+)═10-11 mol?L-1,C(0H-)═10-3mol?L-1,
NH3?H2O?NH4++OH-
起始(mol?L-1) 0.1 0 0
反应(mol?L-1) 10-3 10-3 10-3
平衡(mol?L-1) 0.1-10-3 10-3 10-3
所以NH3?H2O的电离平衡常数为Kb=
=1.01×10-5mol?L-1;
故答案为:1.01×10-5mol?L-1;
b、2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ/mol
c、H2O(g)═H2O(l)△H=-44.0kJ/mol
依据盖斯定律计算a-b+c×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8KJ/mol;
②依据原电池图示可知氢离子移向电极为正极,氧气应从正极通入,c口是氧气通入的一端,负极是甲醇燃料失电子在酸性环境中生成二氧化碳,电极反应为:CH3OH-6e-+H2O=CO2+6H+;
故答案为:c,CH3OH-6e-+H2O=CO2+6H+;
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.1mol?L-1 NaOH溶液中,所得溶液的pH=8,判断溶液在为碳酸氢钠,碳酸氢根离子水解溶液呈碱性,溶液中离子浓度由大到小的顺序是:c(Na+)>C(HCO3-)>c(OH-)>c(H+)>c(CO32-);
故答案为:c(Na+)>C(HCO3-)>c(OH-)>c(H+)>c(CO32-);
(2)NO(g)+NO2(g)═N2O3(g),△H<0,若该反应在绝热、恒容的密闭体系中进行,是气体体积减小的放热反应;
a、t1时正反应速率仍然在变化,说明没有达到平衡状态,故a错误;
b、t1时平衡常数不再变化,正逆反应速率相等,说明达到了平衡状态,故b正确;
c、t1时三氧化二氮和一氧化氮的物质的量还在变化,说明正逆反应速率不相等,反应没有达到平衡状态,故c错误;
d、t1时一氧化氮的质量分数不再变化,表明正逆反应速率相等,达到了平衡状态,故d正确;
故选bd;
(3)当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2+O2?2SO3
1 2
x 0.18mol
x=0.09mol
v(O2)=
| ||
| 0.5min |
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
故答案为:0.036mol.L-1?min-1;向正反应方向移动;
(4)氨水溶液pH=11,则C(H+)═10-11 mol?L-1,C(0H-)═10-3mol?L-1,
NH3?H2O?NH4++OH-
起始(mol?L-1) 0.1 0 0
反应(mol?L-1) 10-3 10-3 10-3
平衡(mol?L-1) 0.1-10-3 10-3 10-3
所以NH3?H2O的电离平衡常数为Kb=
| 10-3×10-3 |
| 0.1-10-3 |
故答案为:1.01×10-5mol?L-1;
点评:本题考查了热化学方程式和盖斯定律计算应用,原电池原理和电极反应书写,化学平衡状态判断,反应速率计算,注意弱电解质电离平衡常数的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
把镁带投入盛有盐酸的敞口容器里,下列因素对反应速率有影响的是( )
①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度.
①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度.
| A、①② | B、③④ |
| C、①②③④ | D、①②③ |
下列情况下,一定能在溶液中同时大量共存的离子组是( )
| A、pH=2的溶液中:SO42-、K+、NO3-、Mg2+ |
| B、pH试纸呈现红色的溶液:Fe2+、K+、NO3-、Na+ |
| C、水电离出的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、Cl-、SO42- |
| D、中性溶液中:Fe3+、Al3+、NO3-、I-、Cl- |

 某课外活动小组利用下列装置迅速制备少量氯气.提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体.(2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)试回答:
某课外活动小组利用下列装置迅速制备少量氯气.提供的试剂有:浓盐酸、饱和食盐水、氢氧化钠溶液、高锰酸钾固体.(2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)试回答: 传统中药的砷剂俗称“砒霜”,请回答下列问题:
传统中药的砷剂俗称“砒霜”,请回答下列问题: