题目内容
18.下列实验操作、现象和结论均正确的是( )| 选项 | 操作 | 现象 | 结论 |
| A | ①将湿润的红色石蕊试纸靠近试管口 | 试纸不变色 | NH4Cl受热不分解 |
| B | ②中振荡后静置 | 下层液体颜色变浅 | NaOH溶液可除去溶在溴苯中的Br2 |
| C | ③加热 | 洗气瓶中溶液褪色 | 生成了乙烯 |
| D | ④通电 | A极上有红色固体析出 | 不能说明锌的金属性比铜强 |
| A. |  | B. | 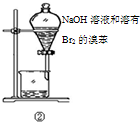 | C. | 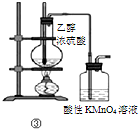 | D. |  |
分析 A.分解得到的氨气与HCl又结合为氯化铵;
B.氢氧化钠与溴反应,溴苯不与水互溶,且密度大于水;
C.挥发出的乙醇也可以使酸性高锰酸钾溶液褪色;
D.A连接电源负极,为阴极,铜离子氧化性比锌离子氧化性强,通电时A极有Cu析出.
解答 解:A.氯化铵受热分解为氨气与HCl,受冷后氨气与HCl又结合为氯化铵,故湿润的红色石蕊试纸靠近试管口试纸不变色,故A错误;
B.氢氧化钠与溴反应,溴苯不与水互溶,且密度大于水,静置后,溶液分层,下层液体颜色变浅,可以用NaOH溶液可除去溶在溴苯中的Br2,故B正确;
C.挥发出的乙醇被酸性高锰酸钾氧化为乙酸,也可以使酸性高锰酸钾溶液褪色,故C错误;
D.A连接电源负极,为阴极,通电时,A电极发生还原反应,有Cu析出,铜离子氧化性比锌离子氧化性强,说明Zn的金属性比Cu强,故D错误,
故选B.
点评 本题考查实验方案设计与评价,C选项为易错点,学生容易考虑乙烯,而忽略挥发出的乙醇,是对学生综合能力的考查,难度中等.

练习册系列答案
相关题目
9.实验室中可用KMnO4来制取氧气.KMnO4中锰元素的化合价为( )
| A. | +7 | B. | +5 | C. | +3 | D. | -7 |
6.设NA代表阿伏伽德罗常数的值.下列叙述正确的是( )
| A. | 将CO2通过Na2O2使其增重a g时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1mol Cl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 常温常压下,3.0 g 含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA | |
| D. | 2.24L的CH4中含有的C-H键数为0.4NA |
13.(1)室温时纯水中 c(H+)=c(OH-),向纯水中加入少量下列固体物质:
A、NaOH B、Na2SO4 C、NH4Cl
试回答如下问题:
Ⅰ.溶液中H+、OH-浓度变化情况(填“增大”、“减少”、“不变”);
Ⅱ.c(H+)与 c(OH-)大小比较(填“>”、“<”、“=”);
Ⅲ.溶液的酸碱性(填“酸性”、“碱性”、“中性”);
请按上述要求补充完整表中相关内容:
(2)已知25℃合成氨反应中,1molN2完全转化为NH3时释放的能量为92.4kJ.现将1molN2和3molH2混全置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol.试回答:
①该反应的热化学方方程式为N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②该反应达到平衡后,升高温度平衡向逆 (填“正”、“逆”)反应方向移动;增大压强平衡向正 (填“正”、“逆”)反应方向移动;加入催化剂平衡不能(填“能”、“不能”)移动;
③前2s内v(H2)为0.15mol/(L•s).
A、NaOH B、Na2SO4 C、NH4Cl
试回答如下问题:
Ⅰ.溶液中H+、OH-浓度变化情况(填“增大”、“减少”、“不变”);
Ⅱ.c(H+)与 c(OH-)大小比较(填“>”、“<”、“=”);
Ⅲ.溶液的酸碱性(填“酸性”、“碱性”、“中性”);
请按上述要求补充完整表中相关内容:
| A、NaOH | B、Na2SO4 | C、NH4Cl | |
| c(H+) | 减小 | ① | 增 大 |
| c(OH-) | ② | 不 变 | ③ |
| c(H+)与c(OH-)的大小比较 | ④ | = | > |
| 溶液的酸碱性 | 碱 性 | ⑤ | 酸 性 |
①该反应的热化学方方程式为N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ/mol
②该反应达到平衡后,升高温度平衡向逆 (填“正”、“逆”)反应方向移动;增大压强平衡向正 (填“正”、“逆”)反应方向移动;加入催化剂平衡不能(填“能”、“不能”)移动;
③前2s内v(H2)为0.15mol/(L•s).
3.设NA代表阿佛加德罗常数,下列说法中正确的是( )
| A. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| B. | 常温常压下,17g甲基(-14CH3)所含的中子数为8NA | |
| C. | 0.44g C3H8中含有的共用电子对总数目为0.08NA | |
| D. | 常温常压下,100 mL 0.5 mol/L 的乙酸溶液中,乙酸的分子数目为0.05NA |
7.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,8g CH4含有4NA个氢原子 | |
| B. | 1mol Cu与足量FeCl3溶液反应,转移2NA个电子 | |
| C. | 1L0.1 mol•L-1(NH4)2SO4溶液中含有0.2NA个NH4+ | |
| D. | 10 L pH=l的硫酸溶液中含有的H+离子数为2NA |
8.用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
| A. | 常温常压下,46g有机物C2H6O中含有极性键的数目一定为7NA | |
| B. | 标准状况下,22.4L四氯化碳中所含有的Cl原子数目为4NA | |
| C. | 标准状况下,22.4升H2O中所含分子数大于NA | |
| D. | 常温常压下,33.6L氯气与56 g铁充分反应,转移的电子数为3NA |
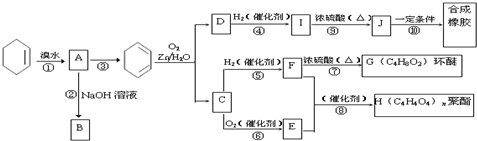
 ; COHC-CHO
; COHC-CHO +2nH2O,
+2nH2O,
 .
.