题目内容
8.下列说法正确的是( )
| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)═4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>①>② | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:C(CH3COO-)>C(CH3COOH)>C(H+)>C(OH-) | |
| D. | 等体积等物质的量浓度的NaF溶液与NaCl溶液中离子总数:N(NaF)>N(NaCl) |
分析 A、0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液是氯化钠、碳酸钠、碳酸氢钠的混合物,根据物料守恒知识来回答;
B、①(NH4)2CO3 ②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液中铵根离子的水解分别收到促进、无影响和抑制作用,据此回答;
C、根据图示信息得到pH=4.5时溶液中含有的离子,并判断离子浓度的大小关系;
D、等体积等物质的量浓度的NaF溶液与NaCl溶液中离子总数是相等的.
解答 解:A、在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时,得到氯化钠、碳酸钠、碳酸氢钠的混合物,不考虑水解,氯离子和碳酸根离子物质的量浓度之比是4:5,根据物料守恒,得到5c(Cl-)═4c(HCO3-)+4c(CO32-)+4c(H2CO3),故A正确;
B、①(NH4)2CO3 ②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液中铵根离子的水解分别收到促进、无影响和抑制作用,铵根离子的水解是对水的电离的促进,物质的量浓度相等的三种溶液中水的电离程度①>③>②,故B错误;
C、从曲线来看当pH>4.5时,c(CH3COOH)<c(CH3COO-),当pH=4.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-),故C错误;
D、HF是弱酸,所以NaF溶液中发生水解反应:F-+H2O?HF+OH-,使溶液呈碱性,氢离子浓度小于10-7mol/L,所以NaCl溶液中C(Na+)+C(H+)大于NaF溶液中C(Na+)+C(H+),根据电荷守恒:C(Na+)+C(H+)=C(OH-)+c(Cl-)可得溶液中离子总数为2×[c(Na+)+c(H+)]×V;同理可得NaF溶液中总数为2×[c(Na+)+c(H+)]×V,所以NaCl溶液中离子总数大于NaF溶液,故D错误.
故选A.
点评 本题主要考查了盐类水解和电荷守恒等综合知识,难度不大,根据所学知识即可完成,注意双水解类型的盐的水解原理是关键.

| A. | 金属腐蚀的本质是金属原子失去电子而被氧化 | |
| B. | 钢铁吸氧腐蚀的正极反应是:O2+4e-+2H2O=4OH- | |
| C. | 氢氧燃料电池中,氢气在负极发生氧化反应 | |
| D. | 将地下钢管与直流电源的正极相连,用来保护钢管 |
| A. | 816O2是818O2的同分异构体 | B. | 818O2是O3的一种同素异形体 | ||
| C. | 816O2与818O2互为同位素 | D. | 1mol 818O2分子中含有20mol电子 |
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 使甲基橙变红的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:ClO-、MnO4-、Al3+、CH3CH2OH | |
| D. | 0.1mol/L的氯化铁溶液中:Na+、SO42-、Cl-、C6H5OH |
| A. | MgO | B. | NaCl | C. | SiO2 | D. | K2S |
 对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )| A. | 分子式为SN | |
| B. | 分子中既有极性键又有非极性键 | |
| C. | 分子中所有共价键的键长一定相等 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
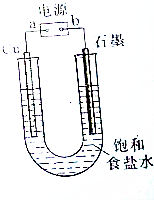 用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.
用如图所示装置电解饱和食盐水制Cl2、H2和NaOH.