题目内容
【题目】(1)①0.1 mol/L (NH4)2SO4溶液中各种离子的浓度由大到小顺序为__________。
②用离子方程式表示NaHCO3溶液显碱性的原因:______________。实验室中配制FeCl3溶液时常加入________溶液以抑制其水解。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=____________mol/L,在pH=3的CH3COOH溶液中,水电离出的c(H+)=__________ mol/L。
(3)利用反应Cu + H2O2 + H2SO4 = CuSO4 + 2H2O设计一个原电池,回答下列问题:
①负极材料为____________;正极反应式为__________________________。
②反应过程中SO42-向_______极移动。
③当电路中转移0.1mol电子时,电解液质量(不含电极)增加了______克。
【答案】c(NH4+)>c(SO42-)>c(H+)>c(OH-) HCO3-+H2O![]() H2CO3+OH- 盐酸 10-3 10-11 Cu H2O2 + 2H+ +2e-= 2H2O 负 3.2
H2CO3+OH- 盐酸 10-3 10-11 Cu H2O2 + 2H+ +2e-= 2H2O 负 3.2
【解析】
(1)①硫酸铵为强酸弱碱盐,其水溶液呈酸性,故溶液中离子浓度从大到小的顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-);
②碳酸氢钠溶液呈碱性,其原因是碳酸氢根在水中发生的水解,水解方程式为HCO3-+H2O![]() H2CO3+OH-;Fe3+在水溶液中溶液发生水解,故配制溶液是应加入少量的盐酸抑制水解;
H2CO3+OH-;Fe3+在水溶液中溶液发生水解,故配制溶液是应加入少量的盐酸抑制水解;
(2)由于醋酸根发生水解,故溶液中c(OH-)=10-3mol/L,由于OH-由水电离而来,水电离出的H+的浓度为10-3mol/L;醋酸在水溶液中电离,抑制的水的电离,故水中c(OH-)=10-11mol/L,水电离出的H+浓度为10-11mol/L;
(3)①方程式中Cu失去电子变成Cu2+,在原电池中做负极,H2O2中O原子得电子变成H2O,故负极材料为Cu,正极反应式为H2O2 + 2H+ +2e-= 2H2O;
②反应过程中负极有大量阳离子生成,需要阴离子平衡电荷,故溶液中硫酸根向负极移动;
③当电路中转移0.1mol电子,负极减少3.2g,同时总反应未生成气体、沉淀等物质,故电解质溶液质量增加3.2g。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如图所示。
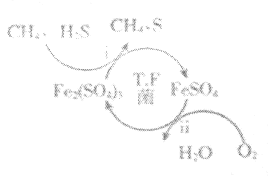
(1)过程i中H2S发生了___(填“氧化”或“还原”)反应。
(2)过程ii的离子方程式是___。
(3)已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.4 | 2.7 | 3.0 |
Fe2+氧化速率/(g·L-1·h-1) | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 | 6.2 | 5.6 |
请结合以上信息,判断工业脱硫应选择的最佳pH范围,并说明原因:___。
II.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
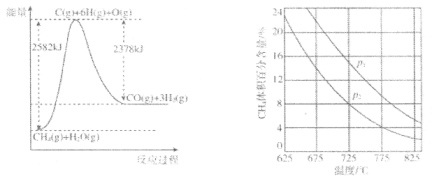
(4)①该过程的热化学方程式是___。
②比较压强p1和p2的大小关系:p1___p2(选填“>”“<”或“=”)。
III.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
IV.H2提纯:将CO2和H2分离得到H2的过程示意图如图。
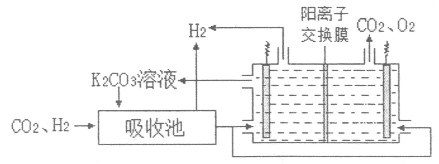
(5)①吸收池中发生反应的离子方程式是___。
②结合电极反应式,简述K2CO3溶液的再生原理:___。