题目内容
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
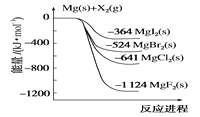
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2>MgBr2>MgCl2>MgF2
C.金属镁和卤素单质(X2)的反应都是放热反应
D.由图可知,此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为MgBr2(s)+Cl2(g)→MgCl2(s)+Br2(g)-117kJ
【答案】C
【解析】
A.由图可知,Mg与Cl2的能量高于MgCl2,则由MgCl2制取Mg是吸热反应,故A错误;
B.物质的能量越低越稳定,由图可知化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故B错误;
C.金属镁和卤素单质(X2)的能量均比生成物能量高,则均为放热反应,故C正确;
D.由图可知①Mg(s)+Cl2(l)=MgCl2(s)△H=-641kJ/mol、
②Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,结合盖斯定律可知,①-②得到MgBr2(s)+Cl2(g)═MgCl2(s)+Br2(g)△H=-117kJmol-1,放热,故D错误;
故答案为C。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目