题目内容
(1)已知25℃、101kPa时,一些物质的燃烧热为:
请回答下列问题:
①该条件下CH3OH(l)完全燃烧的热化学方程式为:______.
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)═CH3OH(l)△H=______.
(2)①常温下,0.10mol/LNH4Cl溶液pH______7(填>、=、<),溶液中各离子浓度由大到小的顺序是______.
②相同物质的量浓度的Na2S溶液与NaHS溶液,pH大小关系是Na2S______NaHS(填>、=、<),两种溶液中微粒种类:Na2S______NaHS(填>、=、<).
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| △H/(kJ?mol-1) | -283.0 | -285.8 | -726.5 |
①该条件下CH3OH(l)完全燃烧的热化学方程式为:______.
②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)═CH3OH(l)△H=______.
(2)①常温下,0.10mol/LNH4Cl溶液pH______7(填>、=、<),溶液中各离子浓度由大到小的顺序是______.
②相同物质的量浓度的Na2S溶液与NaHS溶液,pH大小关系是Na2S______NaHS(填>、=、<),两种溶液中微粒种类:Na2S______NaHS(填>、=、<).
(1)①燃烧热的概念:在25℃、101kPa时,1mol可燃物完全燃烧生成稳定的氧化物时放出的热量.此时S应转化为SO2,C应转化为二氧化碳,H应转化为液态水.
故△H═-726.5kJ?mol-1指的是1molCH3OH(l)完全燃烧生成二氧化碳和液态水时的反应热,
故CH3OH(l)完全燃烧的热化学方程式:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ?mol-1
故答案为:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5KJ?mol-1;
②CO燃烧的热化学方程式:CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1 ①
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ?mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ?mol-1 ③
将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-128.1KJ?mol-1
故答案为:-128.1KJ?mol-1;
(3)NH4+水解生成NH3?H2O和H+,呈酸性,则溶液中c(H+)>c(OH-),c(Cl-)>c(NH4+),由于水解程度较小,则c(NH4+)>c(H+),则离子大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:<;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)Na2S以第一步水解,Na2S的水解程度大于NaHS,所以Na2S的PH大于NaHS,溶液中还存在HS-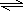 H++S2-,所以两种溶液中微粒种类相同,
H++S2-,所以两种溶液中微粒种类相同,
故答案为:>;=.
故△H═-726.5kJ?mol-1指的是1molCH3OH(l)完全燃烧生成二氧化碳和液态水时的反应热,
故CH3OH(l)完全燃烧的热化学方程式:CH3OH(l)+
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
②CO燃烧的热化学方程式:CO(g)+
| 1 |
| 2 |
H2燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(l)△H=-285.8×2 kJ?mol-1 ②
CH3OH燃烧的热化学方程式:CH3OH(l)+
| 3 |
| 2 |
将①+②+(-③)可得:CO(g)+2H2(g)═CH3OH(l)△H=-128.1KJ?mol-1
故答案为:-128.1KJ?mol-1;
(3)NH4+水解生成NH3?H2O和H+,呈酸性,则溶液中c(H+)>c(OH-),c(Cl-)>c(NH4+),由于水解程度较小,则c(NH4+)>c(H+),则离子大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:<;c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)Na2S以第一步水解,Na2S的水解程度大于NaHS,所以Na2S的PH大于NaHS,溶液中还存在HS-
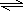 H++S2-,所以两种溶液中微粒种类相同,
H++S2-,所以两种溶液中微粒种类相同,故答案为:>;=.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目