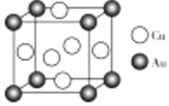
题目内容
【题目】一定质量的某铁的氧化物FexOy与100mL 0.1 mol·L-1 稀硫酸恰好反应完全,得到溶液Z。若用相同质量的该铁的氧化物与CO或H2在高温下反应,反应需要标准状况下CO或H2的体积分别为V1和V2。下列说法正确的是
A.x=2、y=3B.Z溶液一定能使酸性KMnO4溶液褪色
C.V1=V2D.V1和V2的体积不能确定
【答案】C
【解析】
FexOy与100mL 0.1 mol·L-1 稀硫酸恰好反应完全生成FeCl3、FeCl2中的一种或两种,根据已知条件无法确定x和y的值,Z溶液不一定有FeCl2,不一定能使酸性KMnO4溶液褪色,但是根据电荷守恒,可以确定FexOy中Fe元素所带正电荷的物质的量等于n(Cl)=0.1L×0.1 mol·L-1=0.01mol;若用相同质量的该铁的氧化物与CO或H2在高温下反应,最终生成单质Fe,该过程是氧化还原反应,FexOy作氧化剂得电子,Fe元素化合价下降到0价,则得电子的物质的量等于FexOy中Fe元素所带正电荷的物质的量为0.01mol,又因为CO或H2反应后分别生成CO2和H2O,都失去2个电子,根据氧化还原反应中得失电子守恒可知,需要标准状况下CO或H2的体积相等,即V1=V2= ![]() =0.112L,故选C。
=0.112L,故选C。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目