题目内容
【题目】CS(NH2)2(硫脲,白色而有光泽的晶体,溶于水,20℃时溶解度为13.6g;在150 ℃时转变成 NH4SCN)是用于制造药物、染料、金属矿物的浮选剂等的原料。某化学实验小组同学用Ca(HS)2与CaCN2(石灰氮)合成硫脲并探究其性质
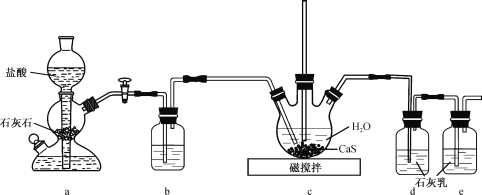
(1)制备Ca(HS)2溶液,所用装置如图(已知酸性:H2CO3>H2S):
①装置a中反应发生的操作为 ______________________________________;装置b中盛放的试剂是__________________ 。
②装置c中的长直导管的作用是____________________________________,三颈烧瓶中通入CO2 不能过量,原因是 ______________________________ 。
(2)制备硫脲:将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成一种常见的碱,合适的加热方式是___________________________;该反应的化学方程式为___________________________________________________________________。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,验证有NH4SCN生成,可用的试剂是_____________(填化学式,下同)
②向盛有少量硫脲的试管中加入NaOH溶液,有NH3放出,检验该气体的方法为 __________________________________________________。
③可用酸性KMnO4溶液滴定硫脲,已知MnO4- 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42— ,该反应中氧化剂与还原剂的物质的量之比为_____________。
【答案】打开装置a、b 之间的活塞 饱和 NaHCO3 溶液 作安全导管,避免烧瓶内压强过大 CO2过量会使产物CaCO3转化为Ca(HCO3)2,不利于与 Ca(HS)2分离 热水浴 2CaCN2 + Ca(HS)2+ 6H2O ![]() 2CS(NH2)2 + 3Ca(OH)2 FeCl3 用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3 14:5
2CS(NH2)2 + 3Ca(OH)2 FeCl3 用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3 14:5
【解析】
(1)①装置a中,需防止启普发生器内正压力的形成,所以应打开活塞,反应发生的操作为打开装置a、b 之间的活塞;装置b中盛放的试剂,应能除去CO2中混入的HCl,同时又不吸收CO2,所以应加入饱和NaHCO3溶液。答案为:打开装置a、b 之间的活塞;饱和 NaHCO3 溶液;
②当装置c中压力过大时,可通过调节c中的液体量来调节压强,所以长直导管的作用是作安全导管,避免烧瓶内压强过大;实验目的是制取Ca(HS)2,既要考虑生成量,又要考虑分离,因为Ca(HS)2、CaCO3都能与碳酸反应,所以三颈烧瓶中通入CO2 不能过量,原因是 CO2过量会使产物CaCO3转化为Ca(HCO3)2,不利于与Ca(HS)2分离。 答案为:作安全导管,避免烧瓶内压强过大;CO2过量会使产物CaCO3转化为Ca(HCO3)2,不利于与 Ca(HS)2分离;
(2)将CaCN2与Ca(HS)2溶液混合,加热至80℃时,可合成硫脲,同时生成Ca(OH)2,因为温度不高于100℃且需控制,所以合适的加热方式是热水浴;该反应的化学方程式为2CaCN2 + Ca(HS)2+ 6H2O ![]() 2CS(NH2)2 + 3Ca(OH)2。答案为:热水浴;2CaCN2 + Ca(HS)2+ 6H2O
2CS(NH2)2 + 3Ca(OH)2。答案为:热水浴;2CaCN2 + Ca(HS)2+ 6H2O ![]() 2CS(NH2)2 + 3Ca(OH)2;
2CS(NH2)2 + 3Ca(OH)2;
(3)①验证NH4SCN时,既可验证NH4+,又可验证SCN-,但验证SCN-时效果更好,可用的试剂是FeCl3。答案为:FeCl3;
②检验NH3的方法为用湿润的红色石蕊试纸置于试管口,若变蓝则为NH3。答案为:用湿润的红色石蕊试纸置于试管口,若变蓝则为 NH3;
③已知MnO4- 被还原为Mn2+,CS(NH2)2被氧化为CO2、N2及SO42- ,则发生反应的离子方程式为5CS(NH2)2+14MnO4-+32H+ =14Mn2++ 5CO2↑+5N2↑+5SO42- +26H2O,该反应中氧化剂为MnO4-,还原剂为CS(NH2)2,二者的物质的量之比为14:5。答案为:14:5。

 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
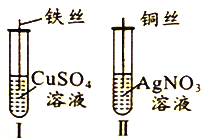
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。