题目内容
15.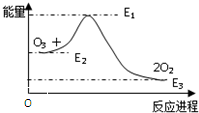 大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )
大气臭氧层的反应是:O+O3═2O2△H,该反应的能量变化如图所示,下列叙述中,正确( )| A. | O+O3═2O2是吸热反应 | B. | O+O3═2O2是放热反应 | ||
| C. | 反应O+O3═2O2的△H=E3-E2 | D. | 反应O+O3═2O2的△H=E3-E1 |
分析 由图可知,O+O3=2O2 的反应为放热反应,△H=E3-E2,利用盖斯定律来分析反应热的关系即可,以此来解答.
解答 解:A、由图可知,反应物O和O3的能量高于产物2O2 的能量,所以反应为放热反应,故A错误;
B、由图可知,反应物O和O3的能量高于产物2O2 的能量,所以反应为放热反应,故B正确;
C、根据焓变的含义△H=产物的焓-反应物的焓,且反应为放热反应,即反应O+O3=2O2的△H=E3-E2,故C正确;
D、根据焓变的含义△H=产物的焓-反应物的焓,且反应为放热反应,即反应O+O3=2O2的△H=E3-E2,故D错误.
故选BC.
点评 本题考查化学反应中的能量变化及盖斯定律,明确信息及图象的分析是解答本题的关键,难度不大.

练习册系列答案
相关题目
6.已知β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质),下面是以锂辉矿为原料来制取金属锂的一种工艺流程.
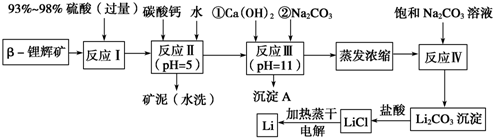
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.
10.水中的NO2-是含氮有机物分解的产物,其浓度的大小是水源污染的标志之一.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对
苯磺酸粉末,实验结果如下表所示:
c.检测:取10mL水样倒入比色管中,加少许对氨基苯磺酸,显色后与标准色阶对比.
请填写以下空白:
①比色法的基本依据是溶液颜色的深浅与浓度的大小成正比;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为1.00mg/L.
③用NaNO2直接配制溶液B的缺点是由②计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配溶液B时误差大.
④如果水样显色后比6号还深,应采取的措施是将水样先稀释一定倍数后再重复实验.
检测水中的NO2-可用比色法,其步骤是:
a.配制标准溶液:称取0.30gNaNO2,溶于水后在容量瓶中稀释至1L得溶液A,移取5mL溶液A,稀释至1L,得溶液
b.配制标准色阶:取6只规格为10mL的比色管(即质地、大小、厚薄相同且具塞的平底试管),分别加入体积不等的溶液B,并稀释至10mL,再加入少许(约0.3g)对
苯磺酸粉末,实验结果如下表所示:
| 色阶序号 | 1 | 2 | 3 | 4 | 5 | 6 |
| 加入溶液B的体积(mL) | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 10.0 |
| 反应后溶液颜色 | 由无色变为由浅到深的樱桃红色 | |||||
请填写以下空白:
①比色法的基本依据是溶液颜色的深浅与浓度的大小成正比;
②若水样显色后与色阶中的5号颜色相同,则表明水样中NO2-含量为1.00mg/L.
③用NaNO2直接配制溶液B的缺点是由②计算可知,1L溶液B中只含NO2-1mg,不易称量,直接配溶液B时误差大.
④如果水样显色后比6号还深,应采取的措施是将水样先稀释一定倍数后再重复实验.
20.下列反应是氧化还原且不是四种基本反应类型的是( )
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
7.NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 0.1 mol C3H6Cl2中化学键总数为NA | |
| B. | 42 g乙烯中含碳原子数为3 NA | |
| C. | 标准状况下,1L苯完全燃烧生成的气态产物的分子数为$\frac{6}{22.4}$NA | |
| D. | 0.1 mol乙醇完全燃烧所消耗的氧分子数一定为0.3 NA |
4.下列做法中不能防止钢铁生锈的是( )
| A. | 安置在潮湿环境中 | B. | 涂油漆 | ||
| C. | 镀铬 | D. | 接镁块 |
5.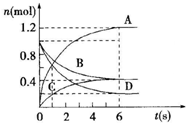 一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为3B+4D═6A+2C | |
| B. | 反应进行到6s时v(B)=v(C) | |
| C. | 反应进行到6s时,用B表示的平均反应速率为0.05mol•L-1•s-1 | |
| D. | 反应进行到6s时,反应停止了 |