题目内容
6.有三溶液:a.Ba(OH)2,b.NaOH,c.NH3•H2O(1)pH值相等时,三种溶液浓度由大到小的顺序为c>b>a
(2)物质的量浓度相等时,pH值由大到小的顺序为a>b>c
(3)pH=11时,各100mL与同浓度的HCl中和,消耗HCl体积由多到少的顺序为c>a=b
(4)浓度相等时,各100mL与同浓度HCl中和,消耗HCl体积由多到少的顺序为b=c<a.
分析 (1)pH=-lgc〔H+〕,pH相同时,NH3•H2O为弱电解质,在溶液中部分电离,所以需要的浓度最大;Ba(OH)2为二元强碱,所以其浓度最小;
(2)三种碱的物质的量浓度相同时,氨水部分电离,溶液中氢氧根离子浓度最小,溶液的pH最小;氢氧化钡中氢氧根离子浓度最大,溶液的pH最大;
(3)三种碱溶液的pH相同、体积也相同时,氢氧化钡和氢氧化钠为强电解质,它们含有的氢氧根离子相同,氨水为弱电解质,含有的氢氧根离子物质的量最大;
(4)中和等量的盐酸,需要的氢氧根离子的物质的量相同,所以需要同浓度的氢氧化钠和氨水的体积相同,氢氧化钡为二元强碱,需要的体积最大.
解答 解:(1)a.Ba(OH)2二元强碱,完全电离,b.NaOH为一元强碱,完全电离,c.NH3•H2O为一元弱碱部分电离;所以三种碱的pH相同时,NH3•H2O为弱电解质,在溶液中部分电离,所以需要的浓度增大;Ba(OH)2为二元强碱,所以其浓度最小,pH相同,三种溶液浓度由大到小的顺序是:c>b>a,
故答案为:c>b>a;
(2)三种碱的物质的量浓度相同时,氨水溶液中氢氧根离子浓度最小,溶液的pH最小,氢氧化钡溶液中氢氧根离子浓度最大,溶液pH最大,所以三种溶液的pH大小关系为:a>b>c,
故答案为:a>b>c;
(3)三种碱溶液的pH相同、体积也相同时,氢氧化钡和氢氧化钠中含有的氢氧根离子相同,氨水为弱电解质,含有的氢氧根离子物质的量最大,与同浓度的HCl中和,消耗HCl体积由多到少的顺序是:c>a=b,
故答案为:c>a=b;
(4)中和等量的盐酸,需要的氢氧根离子的物质的量相同,所以需要同浓度的氢氧化钠和氨水的体积相同,氢氧化钡为二元强碱,需要的体积最小,所以消耗HCl体积由少到多的顺序是:b=c<a,
故答案为:b=c<a.
点评 本题考查了弱电解质的电离平衡、酸碱混合后溶液定性判断及溶液pH的计算,题目难度中等,注意掌握弱电解质的电离平衡较强影响,明确溶液酸碱性与溶液pH的关系及计算方法.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | FeCl3溶液和KSCN溶液混合 | B. | 锌放入稀硫酸中 | ||
| C. | 铜片放入氯化铁溶液中 | D. | 硫酸铜溶液与氢氧化钠溶液混合 |
| A. | 原子半径:r(A)>r(B)>r(D)>r(C) | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) | D. | 元素的金属性:A>B>D>C |
| A. | 1,2-二甲基戊烷 | B. | 2-乙基-3-戊烯 | ||
| C. | 3,4-二甲基-4-丁醇 | D. | 3-甲基-2-戊醇 |
| A. | 碘化钠 | B. | 硫酸铁 | C. | 硝酸银 | D. | 氢氧化钾 |
| A. | 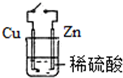 原电池能加快反应速率 | B. | 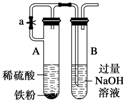 制备Fe(OH)2 | ||
| C. | 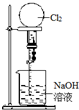 喷泉实验 | D. | 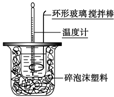 中和热的测定 |
| A. | 大力发展火力发电,解决电力紧张问题 | |
| B. | 在屋顶安装太阳能热水器为居民提供生活用热水 | |
| C. | 用石灰对煤燃烧后形成的烟气脱硫,并将炉渣制成建筑材料 | |
| D. | 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气 |
| A. | SO2 | B. | CO | C. | HCHO | D. | NO |