题目内容
6.如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题: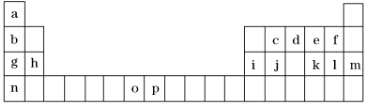
(1)元素p为26号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d64s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量.
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
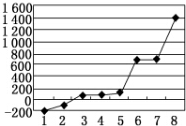
(5)第三周期8种元素按单质熔点高低的顺序如图所示,其中电负性最大的是2(填下图中的序号).
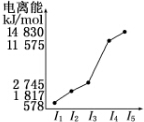
(6)表中所列的某主族元素的电离能情况如图所示,则该元素是Al(填元素符号).
分析 根据元素周期表知,a-p各元素分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe,
(1)Fe原子核外电子数为26,根据能量最低原理书写核外电子排布式;
(2)d与a反应的产物为甲烷,中根据心原子碳原子的价层电子对数判断碳原子的杂化方式;
(3)镁在空气中燃烧发出耀眼的白光,在反应过程中电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,以此答题;
(4)由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态;
(5)第三周期8种元素,只有Si单质为原子晶体,熔点最大,分子晶体的熔点低,有磷、硫、氯气、氩气几种物质,但Cl的电负性最大;
(6)根据表中所列的某主族元素的电离能可知,该元素原子最外层电子数为3,据此答题.
解答 解:(1)Fe原子核外电子数为26,根据能量最低原理可知,其核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)d与a反应的产物为甲烷,中根据心原子碳原子的价层电子对数为$\frac{4+4}{2}$=4,所以碳原子的杂化方式为sp3,
故答案为:sp3;
(3)镁在空气中燃烧发出耀眼的白光,在反应过程中电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,
故答案为:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量;
(4)由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态需要的能量较多;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少,
故答案为:Mn2+的3d轨道电子排布为半满状态,比较稳定;
(5)第三周期8种元素,只有Si单质为原子晶体,熔点最大,与图中8对应;分子晶体的熔点低,有磷、硫、氯气、氩气几种物质,但Cl的电负性最大,与图中2对应,
故答案为:2;
(6)根据表中所列的某主族元素的电离能可知,该元素原子最外层电子数为3,所以该元素为Al元素,故答案为:Al.
点评 本题考查元素周期表的结构、核外电子排布规律、晶体结构与性质、电负性等,题目难度不大,整体把握元素周期表的结构,注意同周期中原子晶体的熔点最高,题目综合性较强.

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
| A. | 偏高 | B. | 偏低 | C. | 不变 | D. | 无法判断 |
| A. | 在1L 0.1mol•L-1氟化钠溶液中含有F-和HF数目之和为0.1NA | |
| B. | 300mL 2mol/L蔗糖溶液中所含分子数为0.6NA | |
| C. | 标准状况下,1.8gD2O中含有NA个中子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有氯原子数目为0.3NA |
| A. | “神十”搭载的长二F改进型火箭推进剂是偏二甲肼(C2H8N2)和四氧化二氮,其中四氧化二氮作氧化剂 | |
| B. | 废弃的金属、纸制品、塑料袋、玻璃都是可回收资源 | |
| C. | 2013年1月2日,印度金矿附近村庄出现砷中毒病例,砷中毒与环境污染有关 | |
| D. | 从2012年3月15日起,国家规定食用碘盐中碘含量为20~30 mg•kg-1,加碘盐中的碘以碘化钾形式存在 |
| A. | 铁屑与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 氢氧化铝溶于稀硝酸:OH-+H+=H2O | |
| D. | 硫酸铁与氢氧化钡反应:Ba2++SO42-=BaSO4↓ |
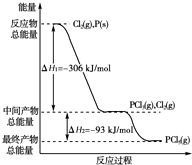 红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
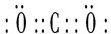 .
.