题目内容
18.已知0.5mol甲烷与0.5mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,该反应的热化学方程式是:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+2akJ/mol.分析 0.5mol甲烷与0.5mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,所以1mol甲烷与1mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了2a kJ热量,根据热化学方程式的意义以及书写方法来回答.
解答 解:甲烷和水蒸气之间的反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g),0.5mol甲烷与0.5mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量,所以1mol甲烷与1mol水蒸气在t℃、p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了2a kJ热量,热化学方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g),△H=+2akJ/mol,
故答案为:CH4(g)+H2O(g)=CO(g)+3H2(g),△H=+2akJ/mol.
点评 本题考查学生热化学方程式的意义以及热化学方程式的书写方面的知识,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.将铁加入到100mL某浓度的盐酸中恰好完全反应,反应后生成的气体为VL(标准状况).将铝加人到100mL 2mol•L-1的NaOH溶液中恰好完全反应,充分反应后生成的气体为3VL.下列说法正确的是( )
| A. | 原铁和铝的物质的量相等 | |
| B. | 原盐酸的浓度为2mol•L-1 | |
| C. | 铁加入盐酸中的离子方程式为2Fe+6H+=2Fe3++3H2↑ | |
| D. | 盐酸与氢氧化钠溶液的物质的量浓度之比为1:3 |
9.下列溶液中溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 将1 L0.5mol/L的浓盐酸加热浓缩为0.5L | |
| D. | 从1000mL 1mol/L NaCl溶液中取出100 mL的溶液 |
6.如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题:
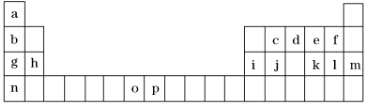
(1)元素p为26号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d64s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量.
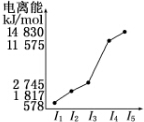
(4)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是Mn2+的3d轨道电子排布为半满状态,比较稳定.
(5)第三周期8种元素按单质熔点高低的顺序如图所示,其中电负性最大的是2(填下图中的序号).
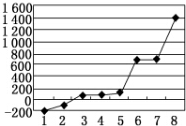
(6)表中所列的某主族元素的电离能情况如图所示,则该元素是Al(填元素符号).

(1)元素p为26号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d64s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量.
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
(5)第三周期8种元素按单质熔点高低的顺序如图所示,其中电负性最大的是2(填下图中的序号).

(6)表中所列的某主族元素的电离能情况如图所示,则该元素是Al(填元素符号).

13.X、Y、Z、W、R五种短周期元素原子序数依次增大,X是周期表中原子半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,其氢氧化物能溶于强碱溶液但不溶于氨水,W单质是人类将太阳能转变为电能的常用材料.下列说法正确的是( )
| A. | 热稳定性:X2R>X2Y | |
| B. | WY2能与碱反应,但不能与任何酸反应 | |
| C. | Z位于第三周期第ⅢA族,Z与Y形成的化合物是一种比较好的耐火材料 | |
| D. | 使甲基橙变红色的溶液中:K+、R2-、ZY2-、WY32- 一定能大量共存 |
3.下列有关高分子化合物的叙述正确的是( )
| A. | 高分子化合物极难溶解 | |
| B. | 高分子化合物依靠分子间作用力结合,材料强度较小 | |
| C. | 高分子均为长链状分子 | |
| D. | 高分子材料均为混合物 |
10.下列热化学方程式的书写,正确的是( )
| A. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2+3H2?2NH3△H=-38.6kJ•mol-1 | |
| B. | 已知在105Pa,298K条件下,2mol H2燃烧生成水蒸气放出484kJ热量,则其热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1 | |
| C. | 甲烷的标准燃烧热数值为890.3kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| D. | 已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1mol水时放出的热量为57.3kJ |
7.关于氧化镁和氧化铝比较的结论中不正确的是( )
| A. | 都能溶于浓盐酸或浓硝酸中 | |
| B. | 都能溶于氢氧化钠溶液中 | |
| C. | 它们的熔点都很高,常用做耐火材料 | |
| D. | 常温下都不能与水反应 |
8.在标准状况下,2mol氯气的体积是( )
| A. | 100 L | B. | 10 L | C. | 11.2L | D. | 44.8L |