题目内容
1.如图1代表元素周期表的一部分.表中所列的字母分别代表某一元素.
(1)写出B的最高价氧化物的电子式
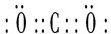 .
.(2)表中的另一种金属元素(未标出)的单质G,可以发生如图2所示转化其中化合物M是一种白色胶状沉淀,K的溶液与B的某种氧化物反应的化学方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;L与氨水反应生成M和盐,则该纯净盐溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-); 一种新型无机非金属材料由G元素和C元素组成,其化学式为AlN.
(3)E与A的正盐水溶液显碱性,用离子方程式解释原因S2-+H2O?OH-+HS-
(4)E的低价氧化物通入F单质的水溶液中,发生反应的离子方程式为Cl2+SO2+2H2O═SO42-+2Cl-+4H+.
(5)A、G、E、F四种元素简单离子的离子半径由小到大的顺序是:Al3+<Na+<Cl-<S2-.
分析 根据元素在周期表中的分布,可以推知:A是Na,B是C,C是N,D是O,E是S,F是Cl,
(1)二氧化碳是碳原子和氧原子之间通过共价双键形成的共价化合物;
(2)表中的另一种金属元素(未标出)的单质G,根据如图2所示转化,G能与氢氧化钠反应,所以G为Al,则G与氢氧化钠反应生成K为NaAlO2,K与二氧化碳反应生成M为Al(OH)3,铝与氯气反应生成L为AlCl3,L与氨水反应生成氢氧化铝;
(3)E与A的正盐水溶液为硫化钠,硫离子水解使溶液显碱性;
(4)E的低价氧化物为二氧化硫,二氧化硫通入氯水中发生氧化还原反应生成硫酸和盐酸;
(5)根据离子的电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小.
解答 解:根据元素在周期表中的分布,可以推知:A是Na,B是C,C是N,D是O,E是S,F是Cl,
(1)二氧化碳是碳原子和氧原子之间通过共价双键形成的共价化合物,其电子式为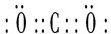 ,故答案为:
,故答案为: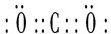 ;
;
(2)表中的另一种金属元素(未标出)的单质G,根据如图2所示转化,G能与氢氧化钠反应,所以G为Al,则G与氢氧化钠反应生成K为NaAlO2,K与二氧化碳反应生成M为Al(OH)3,反应的离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,铝与氯气反应生成L为AlCl3,L与氨水反应生成氢氧化铝和氯化铵,氯化铵溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-),一种新型无机非金属材料由G元素和C元素组成,其化学式为AlN,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;c(Cl-)>c(NH4+)>c(H+)>c(OH-);AlN;
(3)E与A的正盐水溶液为硫化钠,硫离子水解使溶液显碱性,反应的离子方程式为S2-+H2O?OH-+HS-,
故答案为:S2-+H2O?OH-+HS-;
(4)E的低价氧化物为二氧化硫,二氧化硫通入氯水中发生氧化还原反应生成硫酸和盐酸,反应的离子方程式为Cl2+SO2+2H2O═SO42-+2Cl-+4H+,
故答案为:Cl2+SO2+2H2O═SO42-+2Cl-+4H+;
(5)因离子的电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以Na+、Al3+、S2-、Cl-的离子半径由小到大的顺序是Al3+<Na+<Cl-<S2-,
故答案为:Al3+;Na+;Cl-;S2-.
点评 本题考查学生元素周期表的结构和元素周期律的相关知识,综合性较强,难度较大.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 80g | B. | 160g | C. | 98g | D. | 无法确定 |
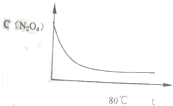 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为N2O4?2NO2,表中b>c(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L•s).
(3)该反应的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A.N2O4的转化率越高 B.NO2的产量越大 C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
(5)要增大该反应的K值,可采取的措施D
A.增大N2O4起始浓度 B.向混合气中通入NO2 C.使用高效催化剂 D.升高温度
(6)如图是80℃时容器中N2O4浓度随时间t的变化图,请在该图中补画出该反应在60℃反应时N2O4浓度的变化曲线.
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | |
| C. | 将1 L0.5mol/L的浓盐酸加热浓缩为0.5L | |
| D. | 从1000mL 1mol/L NaCl溶液中取出100 mL的溶液 |
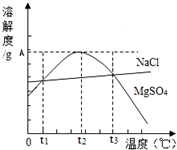
| A. | 只有在t1℃时,NaCl和MgSO4的溶解度才相等 | |
| B. | t1℃~t2℃,MgSO4的溶解度随温度升高而减小 | |
| C. | 在t2℃时,MgSO4饱和溶液的溶质质量分数最大 | |
| D. | 把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出 |
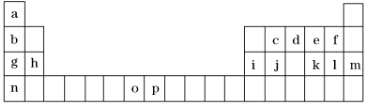
(1)元素p为26号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d64s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量.
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
(5)第三周期8种元素按单质熔点高低的顺序如图所示,其中电负性最大的是2(填下图中的序号).
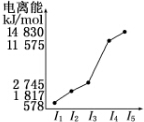
(6)表中所列的某主族元素的电离能情况如图所示,则该元素是Al(填元素符号).
| A. | 热稳定性:X2R>X2Y | |
| B. | WY2能与碱反应,但不能与任何酸反应 | |
| C. | Z位于第三周期第ⅢA族,Z与Y形成的化合物是一种比较好的耐火材料 | |
| D. | 使甲基橙变红色的溶液中:K+、R2-、ZY2-、WY32- 一定能大量共存 |
| A. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2+3H2?2NH3△H=-38.6kJ•mol-1 | |
| B. | 已知在105Pa,298K条件下,2mol H2燃烧生成水蒸气放出484kJ热量,则其热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1 | |
| C. | 甲烷的标准燃烧热数值为890.3kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| D. | 已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1mol水时放出的热量为57.3kJ |