题目内容
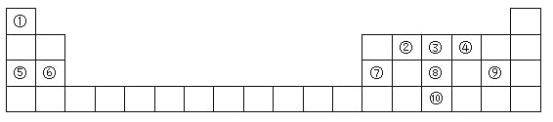
【题目】元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,请参照元素①﹣⑩在表中的位置回答下列问题。
(1)画出⑩的原子结构示意图:______________________;
(2)③、④、⑧的气态氢化物稳定性由小到大的顺序是:(填化学式)__________________;
(3)⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是:(填化学式)__________________;
(4)②、④两元素形成的AB2型物质的电子式是:_______________________;
(5)①、④、⑤、⑨中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的化学式:________________________________
【答案】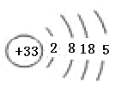 PH3<NH3<H2O HClO4>H3PO4
PH3<NH3<H2O HClO4>H3PO4 ![]() NaOH或NaClO或Na2O2
NaOH或NaClO或Na2O2
【解析】
由元素在周期表中的相对位置可以知道:①是H、②是C、③是N、④是O、⑤是Na、⑥是Mg、⑦是Al、⑧是P、⑨是Cl、⑩是As。
(1)⑩是As,核电荷数33,原子核外四个电子层,最外层5个电子,原子结构示意图为:![]() ,故本题正确答案是:
,故本题正确答案是:![]() ;
;
(2)非金属性越强对应气态氢化物越稳定,③、④、⑧的气态氢化物是:NH3、H2O、PH3,稳定性由小到大的顺序PH3<NH3<H2O,故本题正确答案是:PH3<NH3<H2O;
(3)非金属性越强,最高价含氧酸的酸性越强,⑧、⑨的最高价氧化物对应水化物的酸性强弱顺序是,HClO4>H3PO4,故本题正确答案是:HClO4>H3PO4;
(4)②、④两元素形成的AB2型物质为CO2,碳原子和两个氧原子分别形成两个共用电子对,其电子式为:![]() ,故本题答案为:
,故本题答案为:![]() ;
;
(5)H、O、Na、Cl中的某些元素可形成既含离子键又含共价键的化合物有NaOH或NaClO或Na2O2,故本题答案为:NaOH或NaClO或Na2O2。