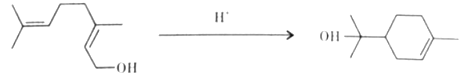
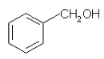
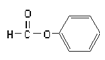
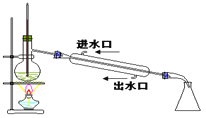
题目内容
【题目】如图为原电池装置示意图,
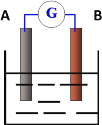
(1)若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为________极 (填正或负),写出电极反应式:正极____________负极_________________。
(2)若A为Zn,B为Cu,电解质溶液为稀硫酸,则A电极名称为 _________,写出正极的电极反应式___________。
(3)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47g,试计算产生标准状况氢气的体积为多少L?(请写出计算过程)___________。
【答案】正 Fe3+ + e- =Fe2+ Fe —2e-=Fe2+ 负极 2H++2e-=H2↑ 4.48 L
【解析】
(1) 若A为铜片,B为铁片,电解质为FeCl3溶液,发生的总反应式为:2FeCl3 + Fe =3FeCl2,则铁为负极,铜为正极;
(2)A为Zn,B为Cu,电解质溶液为稀硫酸,该原电池的总反应为:Zn+H2SO4=ZnSO4+H2↑,则锌为负极,铜为正极;
(3)可根据电极减小的总质量(即参与反应的锌的质量)求出生成氢气的质量,进而求出其物质的量,根据V=n×22.4求出生成的氢气的体积。
(1)该原电池中,铁为负极,铜为正极,铁失电子变成离子进入溶液,正极上铁离子得电子生成亚铁离子,正极的电极反应式为:Fe3+ + e- =Fe2+,负极的电极反应式为:Fe -2e-=Fe2+;
(2)A为Zn,B为Cu,电解质溶液为稀硫酸,该原电池的总反应为:Zn+H2SO4=ZnSO4+H2↑,锌为负极,铜为正极,正极的电极反应式为:2H++2e-=H2↑,负极的电极反应式为:Zn -2e-= Zn2+;
(3)原来两电极的总质量为60 g,干燥后称的电极总质量为47 g,质量变小了,原因是锌电极参与反应,部分溶解了,溶解的质量为60-47=13 g,根据原电池的总反应为:Zn+H2SO4=ZnSO4+H2↑可列出: 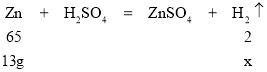
解得x=0.4g,故产生的氢气的物质的量为:n=![]() ,产生的氢气的体积(标况下)为:V=0.2×22.4 L·mol-1=4.48 L。
,产生的氢气的体积(标况下)为:V=0.2×22.4 L·mol-1=4.48 L。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案【题目】I.下面列出了几组物质,请用物质的组号填写下表。
类型 | 同位素 | 同素异形体 | 同分异构体 | 同系物 |
组号 | __ | __ | __ | __ |
① ![]() 与
与![]() ②
② ![]() 与
与![]() ③金刚石和石墨 ④12C、13C、14C ⑤
③金刚石和石墨 ④12C、13C、14C ⑤![]() 和
和![]()
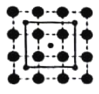
II.下图中A、B、C 分别是三种烃的结构模型:

请回答下列问题:
(1)A 的电子式______________,B 的结构简式________________。
(2)A及其同系物的分子式符合通式_____________(用 n 表示)。当 n=____________时,烷烃开始出现同分异构体;当 n=6 时,同分异构体有__________种。
(3)A、B、C 三种有机物中,所有原子均共面的是___________(填名称)。结构简式为 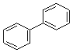 的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
的有机物中,处于同一平面内的原子数最多为__________,处于 同一平面内的碳原子数至少为____________。
(4)有机物 C 不具有的结构或性质是_____________(填字母序号)。
a.是碳碳双键和碳碳单键交替的结构 b.有毒、不溶于水、密度比水小
c.不能使酸性 KMnO4 溶液和溴水反应褪色 d.一定条件下能与氢气或氧气反应
(5)等质量的三种有机物完全燃烧生成 H2O 和 CO2,消耗氧气的体积(相同状况下)最大的是_______(填A 或B 或 C)。
III.某有机物的结构简式如图,1mol 该有机物最多可以和______mol氢气反应,最多可以和_____molNaOH 反应。
【题目】某化学实验小组将装有铜与浓硫酸烧瓶加热一段时间后,取出烧瓶中固体,探究其成分。查资料可知,浓硫酸与铜反应可能生成CuS或Cu2S,它们都难溶于水,能溶于稀硝酸。实验如下:
(i)用蒸馏水洗涤固体,得到蓝色溶液,固体呈黑色。
(ii)取少量黑色固体于试管中,加入适量稀硝酸,黑色固体逐渐溶解,溶液变为蓝色,产生无色气泡。取少量上层清液于试管,滴加氯化钡溶液,产生白色沉淀。
①根据实验(i)得到蓝色溶液可知,固体中含____________(填化学式)
②根据实验(ii)的现象_______(填“能”或“不能”)确定黑色固体是CuS还是Cu2S,理由是__________________________________________________________________________。
写出Cu2S与稀硝酸反应的化学方程式____________________________________________
③为了进一步探究黑色固体的成分,将实验(i)中黑色固体洗涤、烘干,再称取48.0g黑色固体进行如下实验,通入足量O2,使硬质玻璃管中黑色固体充分反应,观察到F瓶中品红溶液褪色。

实验序号 | 反应前黑色固体质量/g | 充分反应后黑色固体质量/g |
I | 48.0 | 48.0 |
Ⅱ | 48.0 | 44.0 |
Ⅲ | 48.0 | 40.0 |
根据上表实验数据推测:实验I中黑色固体的化学式为_____________________________;实验Ⅱ中黑色固体的成分及质量为_______________________________________________。