题目内容
2.aX(g)+bY(g)?cZ(g)+dW(g)在一定体积的密闭容器中反应5min达到平衡时,X减少n mol•L-1,Y减少$\frac{n}{3}$ mol•L-1,Z增加$\frac{2n}{3}$ mol•L-1.若将体系压强增大,W的百分含量不发生变化.则化学方程式中各物质的化学计量数之比a:b:c:d应为( )| A. | 3:1:2:1 | B. | 1:3:2:2 | C. | 3:1:2:2 | D. | 1:3:1:2 |
分析 根据反应中各物质的浓度变化量之比等于化学计量数之比确定a、b、c的比值,根据增大压强平衡不移动,则反应前后气体的计量数相等,可确定化学方程式的计量数d与a、b、c的关系,据此答题.
解答 解:反应中各物质的浓度变化量之比等于化学计量数之比,则a:b:c=n:$\frac{n}{3}$:$\frac{2n}{3}$=3:1:2,增大压强W的百分含量不发生变化,即平衡不移动,则反应前后气体的计量数相等,可得a+b=c+d,即3+1=2+d,则d=2,所以a:b:c:d=3:1:2:2,故选C.
点评 本题主要考查了化学反应速率有关计算、压强对化学平衡的影响,难度不大,原理基础知识的理解巩固.

练习册系列答案
相关题目
12.下列各组混合物,不论两种物质以何种比例混合,只要总质量一定,经完全燃烧后,产生的CO2的质量不变的是( )
| A. | 乙炔和苯酚 | B. | 乙醇和乙酸 | C. | 甲醛和葡萄糖 | D. | 丙烯和丙烷 |
13.中学化学中很多“规律”都有其使用范围,下列根据有关“规律”推出的结论合理的是( )
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据F、Cl、Br、I非金属性依次减弱,推出HF、HCl、HBr、HI的酸性依次减弱 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
10.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和脂肪,苯和汽油 | |
| B. | 油脂和水,溴苯和水,硝基苯和水 | |
| C. | 甲醛和水,蚁酸和水,乙酸和乙醇 | |
| D. | 汽油和水,苯和甲苯,鸡蛋白和水 |
17.褪黑素是一种内源性生物钟调节剂,在人体内由食物中的色氨酸转化得到.下列说法不正确的是( )


| A. | 色氨酸分子中存在氨基和羧基,可形成内盐,具有较高的熔点 | |
| B. | 褪黑素与色氨酸结构相似,也具有两性化合物的特性 | |
| C. | 在一定条件下,色氨酸可发生缩聚反应 | |
| D. | 在色氨酸水溶液中,可通过调节溶液的pH使其形成晶体析出 |
7.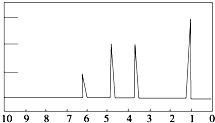 1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )
1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )
 1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )
1H核磁共振谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的1H核磁共振谱如图所示:则该物质可能是下列中的( )| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | CH3CH2CH2CH3 | D. | CH3CH2OH |
11.氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
③下列关于合成氨说法正确是B(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2(g)+3H2(g)$?_{△}^{催化剂}$2NH3(g),△H<0
①该反应的平衡常数K的表达式为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$.升高温度,K值减小(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,200℃、100MPa(填温度和压强)时H2转化率最高,实际工业生产中不选用该条件的主要原因是压强太高生产设备条件难以实现.
氨的平衡(MP)含量%压强温度(℃) | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.其装置为用铂黑作为电极,加入碱性电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为4NH3+3O2=2N2+6H2O,写出负极电极反应式2NH3-6e-+6OH-=N2+3H2O.
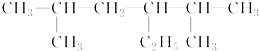 的名称是2,5-二甲基-3-乙基己烷
的名称是2,5-二甲基-3-乙基己烷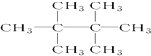 名称是2,2,3,3-四甲基丁烷.
名称是2,2,3,3-四甲基丁烷.