题目内容
19.下列关于化学键的叙述正确的是( )| A. | 只有金属元素和非金属元素化合时才能形成离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| D. | 含有共价键的化合物不一定是共价化合物 |
分析 A、形成离子键的元素可能全部是非金属元素;
B、稀有气体分子中不存在任何化学键;
C、阴阳离子之间通过静电作用形成的化学键是离子键;
D、离子化合物中可能含有共价键.
解答 解;A、形成离子键的元素可能全部是非金属元素,如铵盐,故A错误;
B、稀有气体分子中不存在任何化学键,故B错误;
C、阴阳离子之间通过静电作用形成的化学键是离子键,这种静电作用包含吸引力和排斥力,故C错误;
D、含有共价键的化合物不一定是共价化合物,如NaOH,故D正确;
故选D.
点评 本题考查了离子键、共价键与离子化合物、共价化合物的关系,侧重考查学生对这几个概念的辨别能力;要注意的是:离子化合物中可能含共价键,共价化合物中一定不含离子键.

练习册系列答案
相关题目
10. A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
请回答下列问题:
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
 A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.
A、B、D、E四种元素均为短周期元素,原子序数逐渐增大.A元素原子的核外电子数、电子层数和最外层电子数均相等.B、D、E三种元素在周期表中的相对位置如表所示,只有E元素的单质能与水反应生成两种酸.甲、乙、M、W、X、Y、Z七种物质均由A、B、D三种元素中的一种或几种组成,其中只有M分子同时含有三种元素;W为A、B两元素组成的18电子分子,可作火箭燃料;甲、乙为非金属单质;X分子含有10个电子.它们之间的转化关系如图所示.| B | D | |
| E |
(1)Z的化学式为NO2.
(2)E的单质与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO.
(3)W空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.W空气燃料电池放电时,正极反应式为O2+2H2O+4e-═4OH-,负极反应式为N2H4+4OH--4e-═N2+4H2O.
(4)将一定量的A2、B2的混合气体放入1L密闭容器中,在500℃、2×107Pa下达到平衡.测得平衡气体的总物质的量为0.50mol,其中A2为0.3mol,B2为0.1mol.则该条件下A2的平衡转化率为33.3%.
7.某烃的结构简式为CH3-CH2-CH=C(C2H5)-C≡CH,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
| A. | 4、3、6 | B. | 4、3、5 | C. | 2、5、4 | D. | 4、6、4 |
4.确定某溶液中含有SO42-,下列方案中正确的是( )
| A. | 先加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解 | |
| B. | 先加入足量稀盐酸无沉淀,再加入BaCl2溶液产生白色沉淀 | |
| C. | 先加入足量稀硝酸无沉淀,再加入Ba(NO3)2溶液产生白色沉淀 | |
| D. | 先加入Ba(NO3)2溶液无沉淀,再加入足量稀硝酸产生白色沉淀 |
11.下列事实与氢键有关的是( )
| A. | 水结成冰体积膨胀,密度变小 | |
| B. | CH4、SiH4、GeH4、SnH4的熔点随相对分子质量增大而升高 | |
| C. | He、Ne、Ar、Kr、Xe在水中的溶解度逐渐增大 | |
| D. | 水加热到很高的温度都难以分解 |
8.下列有机物命名正确的是( )
| A. | 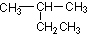 2-乙基丙烷 2-乙基丙烷 | B. | 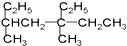 3,5-二甲基-3-乙基庚烷 3,5-二甲基-3-乙基庚烷 | ||
| C. | 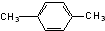 间二甲苯 间二甲苯 | D. | 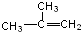 2-甲基-2-丙烯 2-甲基-2-丙烯 |
9.下列四组物质中互为同素异形体的是( )
| A. | 纯碱与苏打 | B. | 12CO和14CO | ||
| C. | CH3CHO与 | D. | 金刚石和富勒烯(C60) |
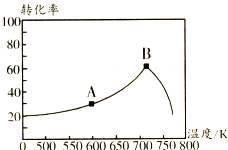 碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息:
碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放.已知如下信息: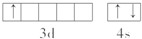 .该元素的原子序数为21,该元素的元素符号是Sc,形成的单质为金属晶体.
.该元素的原子序数为21,该元素的元素符号是Sc,形成的单质为金属晶体.