题目内容
17.下列各原子或离子的电子排布式错误的是( )| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |
分析 原子核外电子排布应符合构造原理、能量最低原理、洪特规则和泡利不相容原理,一般来说离子的核外最外层达到8电子稳定结构,根据构造原理,s能级最多可容纳2个电子,p能级有3个轨道最多可容纳6个电子,电子总是优先从能量低的能层、能级排列,其中s2是原子得两个电子形成的稳定的结构,所以第三能层中的电子排布最多应为3s23p6,据此分析解答.
解答 解:A.Si原子核外有14个电子,核外电子排布式为:1s22s22p63s23p2,故A错误;
B.O原子核外有8个电子,O2-核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故B正确;
C.Na的原子序数为11,离子的核外电子排布式为1s22s22p6,最外层达到8电子稳定结构,故C正确;
D.Al原子核外有13个电子,Al原子核外电子排布式为1s22s22p63s23p1,故D正确;
故选A.
点评 本题考查了原子或离子核外电子排布,明确排布规律及其规则是解本题关键,为考试热点,知道每个能级最多排列的电子数,要遵循构造原理,题目难度不大.

练习册系列答案
相关题目
7.关于盐类水解,下列叙述不正确的是( )
| A. | 是中和反应的逆反应 | |
| B. | 水的电离平衡被破坏 | |
| C. | 盐类水解破坏盐的电离平衡 | |
| D. | 配制硫酸铜溶液时,加入适量的硫酸,是为了抑制硫酸铜的水解 |
8.下列实验或方案正确的是( )
| A. | 在漂白粉中滴入70%的硫酸,立即产生黄绿色气体,说明硫酸具有氧化性 | |
| B. | 久置的酚酞试液有白色沉淀(未变质),加入少量酒精,沉淀消失,再将该溶液滴入NaOH溶液,变红,说明酚酞易溶于酒精 | |
| C. | 在淀粉溶液中加入适量稀硫酸微热,向水解后的溶液中加入新制Cu(OH)2浊液并加热,无红色沉淀,说明淀粉未水解 | |
| D. | 检验蔗糖水解产物具有还原性:在蔗糖水解后的溶液中先加入适量稀NaOH溶液中和,再加入新制的银氨溶液 |
5.下列实验可实现鉴别目的是( )
| A. | 用BaCl2溶液鉴别SO3(g)和SO2 | |
| B. | 用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液 | |
| C. | 用CO2鉴别Na[Al(OH)4]溶液和Na2SiO3溶液 | |
| D. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 |
12.下列离子在酸性溶液中能大量共存的是( )
| A. | Fe3+、NH4+、SCN-、Cl- | B. | Na+、K+、NO3-、SO42- | ||
| C. | Fe2+、K+、Na+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
6.下列混合溶液中,各离子浓度的大小顺序不正确的是( )
| A. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| B. | 物质的量浓度相等Na2CO3和NaHCO3溶液等体积混合:离子浓度的大小顺序是:c (Na+)>c (HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| C. | CH3COONa溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) |
7.下列关于同温同压下,同质量气体H2、D2、T2的叙述中,正确的是( )
①密度比1:2:3 ②质子数比6:3:2 ③中子数比0:3:4 ④体积比6:3:2.
①密度比1:2:3 ②质子数比6:3:2 ③中子数比0:3:4 ④体积比6:3:2.
| A. | ①②③④ | B. | ②③④ | C. | ①②③ | D. | ③④ |
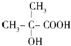
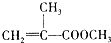 )是有机玻璃的单体,其分子在核磁共振氢谱图中能显示3个不同的峰.下列物质属于甲基丙烯酸甲酯同分异构体的是①④(填选项序号)
)是有机玻璃的单体,其分子在核磁共振氢谱图中能显示3个不同的峰.下列物质属于甲基丙烯酸甲酯同分异构体的是①④(填选项序号)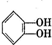 ④
④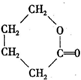
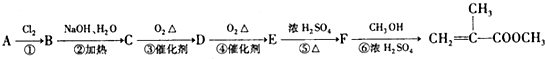
 .
.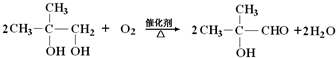 ;
; .
.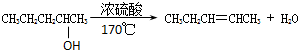 消去反应
消去反应 取代反应
取代反应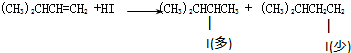 加成反应
加成反应 取代反应
取代反应