题目内容
7.关于盐类水解,下列叙述不正确的是( )| A. | 是中和反应的逆反应 | |
| B. | 水的电离平衡被破坏 | |
| C. | 盐类水解破坏盐的电离平衡 | |
| D. | 配制硫酸铜溶液时,加入适量的硫酸,是为了抑制硫酸铜的水解 |
分析 A、盐的水解是盐和水反应生成对应的酸和碱的过程;
B、盐的水解促进水的电离;
C、盐的水解是盐溶液中的弱离子和水电离出的氢离子或是氢氧根离子结合形成弱电解质的过程;
D、CuSO4水解呈酸性,加入硫酸可抑制水解.
解答 解:A、盐的水解是盐和水反应生成对应的酸和碱的过程,是中和反应的逆反应,故A正确;
B、盐类水解促进水的电离,所以水的电离平衡被破坏,故B正确;
C、盐类水解的过程中,水的电离平衡被破坏,盐是能完全电离的,不存在平衡,故C错误;
D、CuSO4水解呈酸性,加入硫酸,氢离子浓度增大,可抑制水解,故D正确.
故选C.
点评 本题考查学生盐的水解原理以及盐的水解规律知识,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
相关题目
4.室温下0.1mol/L的NH4CN溶液的pH等于9.32.下列说法错误的是( )
| A. | 上述溶液能使甲基橙试剂变黄色 | |
| B. | 室温下,NH3•H2O是比HCN更弱的电解质 | |
| C. | 上述溶液中CN-的水解程度大于NH4+的水解程度 | |
| D. | 室温下,0.1mol/LNaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度 |
5. 光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
 光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )
光刻胶是大规模集成电路印刷电路版技术中的关键材料,某一光刻胶的主要成分如图所示,下列有关说法正确的是( )| A. | 合成此高聚物的单体的化学式为C11H10O2 | |
| B. | 发生加成反应时1 mol该物质可消耗4molH2 | |
| C. | 该物质可稳定存在于碱性溶液中 | |
| D. | 该物质可经过缩聚反应制得 |
2.下列粒子的结构示意图中,表示氯离子的是( )
| A. | 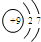 | B. | 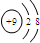 | C. | 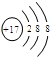 | D. |  |
16.有关高温结构陶瓷和光导纤维说法不正确的是( )
| A. | 光导纤维是一种能高质量传导光的玻璃纤维 | |
| B. | 光导纤维的抗干扰性能好,不发生电辐射,通讯质量高,能防窃听 | |
| C. | 高温结构陶瓷弥补了金属材料的弱点,但是硬度却远远低于金属材料 | |
| D. | 氮化硅陶瓷是一种重要的结构材料,具有超硬性,它能与氢氟酸反应 |
17.下列各原子或离子的电子排布式错误的是( )
| A. | Si 1s22s22p2 | B. | O2- 1s22s22p6 | ||
| C. | Na+ 1s22s22p6 | D. | Al 1s22s22p63s23p1 |