题目内容
【题目】燃煤造成的S2的大量排放已经给我们的生存环境造成了严重破坏,科学研究发现:一定条件下,通过下列反应可实现燃煤烟气中硫的回收。
(1)已知:2CO(g)+2O2(g)=2CO2g) △H1=-566kJ/mol
S(l)+O2(g)=SO2(g) △H2=--296kJ/mol
则反应2CO(g)+SO2(g) ![]() 2CO2(g)十S(l) △H=________ kJ/mol
2CO2(g)十S(l) △H=________ kJ/mol
(2)燃煤烟气中硫的回收反应的平衡常数表达式K=_________。在温度和容积不变时,下列说法正确的是_________ (填字母序号)
A.容器内压强不再改变时,反应达到平衡状态
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.当n((CO):n(SO2):n(CO2)=2:1:2时,反应达到平衡状态
D.其他条件不变,使用不同催化剂,该反应平衡常数变化
(3)假设在容器中发生上述反应,下列能提高SO2转化率的是_________(填字母序号)。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.增大容器的体积
(4)SO2尾气处理的方法之一是将尾气直接通入NaOH溶液中。若将 1mol SO2气体通入1L2mo1/L的NaOH溶液中所得溶液中离子浓度由大到小的顺序为_____________;
(5)尾气中的CO可以制成CO-----空气燃料电池。CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。该电池负极的电极反应式为_______________;总反应式为__________________________________________________。
【答案】 -270 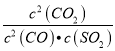 A C c(Na+)>(SO32-)>c(OH-)>c(HSO3-)>c (H+) CO-2e-+O2-=CO2 2CO+O2=2CO2
A C c(Na+)>(SO32-)>c(OH-)>c(HSO3-)>c (H+) CO-2e-+O2-=CO2 2CO+O2=2CO2
【解析】试题分析:(1)根据盖斯定律计算2CO(g)+SO2(g) ![]() 2CO2(g)十S(l)的△H;(2)化学平衡常数是达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不计入平衡常数表达式;根据平衡标志分析是否达到平衡状态;(3)根据平衡移动原理分析提高SO2转化率的方法;(4)1mol SO2气体通入1L2mo1/L的NaOH溶液中恰好生成Na2SO3溶液;(5)CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—,正极反应是氧气得电子生成氧离子,电池负极是CO失电子生成CO2。
2CO2(g)十S(l)的△H;(2)化学平衡常数是达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体不计入平衡常数表达式;根据平衡标志分析是否达到平衡状态;(3)根据平衡移动原理分析提高SO2转化率的方法;(4)1mol SO2气体通入1L2mo1/L的NaOH溶液中恰好生成Na2SO3溶液;(5)CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—,正极反应是氧气得电子生成氧离子,电池负极是CO失电子生成CO2。
解析:(1)①2CO(g)+2O2(g)=2CO2g) △H1=-566kJ/mol
②S(l)+O2(g)=SO2(g) △H2=--296kJ/mol
根据盖斯定律①-②得2CO(g)+SO2(g) ![]() 2CO2(g)十S(l) △H=-270 kJ/mol;(2) S是液体不计入平衡常数表达式,燃煤烟气中硫的回收反应的平衡常数表达式K=
2CO2(g)十S(l) △H=-270 kJ/mol;(2) S是液体不计入平衡常数表达式,燃煤烟气中硫的回收反应的平衡常数表达式K= ;A. 该反应前后气体物质的量是变量,在温度和容积不变时,容器内压强不再改变时一定达到平衡状态,故A正确;B.硫是固体,平衡时,其他条件不变,分离出硫,反应速率几乎不变,故B错误;C.反应物浓度不变时达到平衡状态,当n((CO):n(SO2):n(CO2)=2:1:2时,反应不一定达到平衡状态,故C错误;D.催化剂不能使平衡移动,其他条件不变,使用不同催化剂,反应平衡常数不变,故D错误。(3)催化剂不能使平衡移动,选用更有效的催化剂,SO2转化率不变,故A错误; B.升高反应体系的温度,平衡逆向移动,SO2转化率降低,故B错误;C.降低反应体系的温度,平衡正向移动,SO2转化率增大,故C正确; D.增大容器的体积,平衡逆向移动,SO2转化率降低,故D错误。(4)1mol SO2气体通入1L2mo1/L的NaOH溶液中恰好生成Na2SO3溶液;亚硫酸钠溶液中存在水解平衡
;A. 该反应前后气体物质的量是变量,在温度和容积不变时,容器内压强不再改变时一定达到平衡状态,故A正确;B.硫是固体,平衡时,其他条件不变,分离出硫,反应速率几乎不变,故B错误;C.反应物浓度不变时达到平衡状态,当n((CO):n(SO2):n(CO2)=2:1:2时,反应不一定达到平衡状态,故C错误;D.催化剂不能使平衡移动,其他条件不变,使用不同催化剂,反应平衡常数不变,故D错误。(3)催化剂不能使平衡移动,选用更有效的催化剂,SO2转化率不变,故A错误; B.升高反应体系的温度,平衡逆向移动,SO2转化率降低,故B错误;C.降低反应体系的温度,平衡正向移动,SO2转化率增大,故C正确; D.增大容器的体积,平衡逆向移动,SO2转化率降低,故D错误。(4)1mol SO2气体通入1L2mo1/L的NaOH溶液中恰好生成Na2SO3溶液;亚硫酸钠溶液中存在水解平衡![]() 、
、![]() ,所以溶液中离子浓度由大到小的顺序为c(Na+)>(SO32-)>c(OH-)>c(HSO3-)>c (H+);(5)CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。正极反应是氧气得电子生成氧离子,电池负极是CO失电子生成CO2,负极反应式是CO-2e-+O2-=CO2,总反应是2CO+O2=2CO2。
,所以溶液中离子浓度由大到小的顺序为c(Na+)>(SO32-)>c(OH-)>c(HSO3-)>c (H+);(5)CO----空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—。正极反应是氧气得电子生成氧离子,电池负极是CO失电子生成CO2,负极反应式是CO-2e-+O2-=CO2,总反应是2CO+O2=2CO2。