��Ŀ����
����Ŀ���ù�ҵ�����·ۺ��Ǧп����(��Ҫ�ɷ�ΪZnO��PbSO4������Ϊ��Si��Fe(III)��Cu��Cd��Ԫ�صĻ�����)Ϊԭ�ϣ��ƻ�������п�ͻ�ɫ����Ǧ���ƣ���ҵ������ͼ��ʾ��
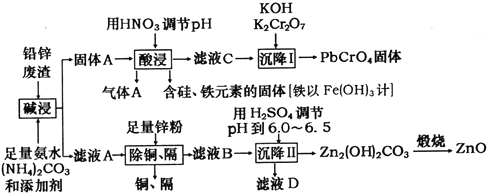
��֪������Ksp(PbSO4)=1.6��10-5��Ksp(PbCO3)=7.4��10-14��Ksp[Fe(OH)3]=1.0��10-38��
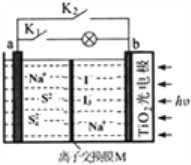
(1)�������������PbSO4������Ӧ�����ӷ���ʽΪ_______________________________������A�Ļ�ѧʽΪ_________________________��
(2)������������У��ڳ�����Ӧ����pH������________________________________��
(3)������I���з���������Ӧ�����ӷ���ʽΪ____________________________��
(4)��ҺD�����ʵ���Ҫ�ɷ�Ϊ________________��
(5)��1t��пԪ��10����Ǧп�����Ƶû�������п113.4kg���������������ܷ�����пԪ�صĻ����ʡ����ܣ�д���������������ܣ���˵�����ɡ�___________________��
(6)������NH3��H2O�ĵ��볣��Kb=1.8��10-5��̼��ĵ��볣����Ka1=4.4��10-7��Ka2=5.6��10-11�����¶���ijŨ�ȵ�(NH4)2CO3��Һ��c(NH4+)��c(NH3��H2O)=18������ҺpHΪ__________________��c(HCO3-)��c(H2CO3)=____________________��
���𰸡� PbSO4 (s) + CO32��(aq) =PbCO3(s) + SO42�� (aq) CO2 3 2Pb2++ 2OH��+Cr2O72��=2PbCrO4��+H2O (NH4)2SO4 ���ܣ���ȥͭ���ӵĹ�����������п�ۣ�����ZnO�е�пԪ�ز���ȫ������Ǧп������������Ǧп������пԪ�صĻ����� 8 44
��������Ǧп����(��Ҫ�ɷ�ΪZnO��PbSO4������Ϊ��Si��Fe(III)��Cu��Cd��Ԫ�صĻ�����)Ϊԭ�ϣ����백ˮ��̼��什��С���������õ�����Ậ��PbCO3�Լ�����Si��Fe(III)�Ļ�����������ᣬ�������������̼�����˵õ����������й�Ļ�������������ȣ���ҺC�к�������Ǧ���������������Լ��ظ���أ����Եõ�PbCrO4���壻��ҺA�к���Zn��Cu��Cd�Ļ��������������п�ۿɳ�ȥCu��Cd����ҺB��Ҫ����п�Ļ��������ϡ�������pH�ɵõ�Zn2(OH)2CO3�����ȷֽ�õ�����п���Դ˽����⡣
��1����֪��������Ksp(PbSO4)=1.6��10-5��Ksp(PbCO3)=7.4��10-14�����ԡ������������PbSO4������Ӧ�����ӷ���ʽΪPbSO4 (s) + CO32��(aq) =PbCO3(s) + SO42�� (aq)��������������������Ϊ������̼����ѧʽΪCO2����ȷ�𰸣�PbSO4 (s) + CO32��(aq) =PbCO3(s) + SO42�� (aq)�� CO2��
(2) ������������У���pH���ͣ�����ǿ�������ᷴӦ���ɵ��й����Ļ����������Һ�У��ټӼ�ʱ�������������������������c(Fe3+)=1��10-5mol/Lʱ��Ksp[Fe(OH)3]= c(Fe3+)��c3(OH-)=1.0��10-38��c(OH-)=10-11mol/L��c(H+)=10-3 mol/L��pH=3�����Ҫ���ȥ�����ӣ��ڳ�����Ӧ����pH������3����ȷ�𰸣�3��
(3)�������̿�֪��Pb2+�ڼ��Ի�������Cr2O72����Ӧ����PbCrO4�����ӷ���ʽΪ2Pb2++ 2OH��+Cr2O72��=2PbCrO4��+H2O����ȷ�𰸣�2Pb2++ 2OH��+Cr2O72��=2PbCrO4��+H2O��
(4) ��ͼ֪��ҺB�к��е�����ΪZn2+ ��NH4+�� CO32-�������������Һ��pH=6-6.5����Zn2(OH)2CO3����ҺΪ(NH4)2SO4 ����ȷ����(NH4)2SO4��
(5) ��ȥͭ���ӵĹ�����������п�ۣ�����ZnO�е�пԪ�ز���ȫ������Ǧп������������Ǧп������пԪ�صĻ����ʣ����Խ���Ϊ���ܣ���ȷ�𰸣����ܣ���ȥͭ���ӵĹ�����������п�ۣ�����ZnO�е�пԪ�ز���ȫ������Ǧп������������Ǧп������пԪ�صĻ����ʡ�
(6) ������NH3��H2O�ĵ��볣��Kb=1.8��10-5����NH4+��ˮ��ƽ�ⳣ��Ϊ1��10-14/1.8��10-5,��Һ�д��ڣ�NH4++H2O=NH3��H2O+H+ ��c(NH3��H2O)��c(H+)/c(NH4+)=1��10-14/1.8��10-5,��֪��c(NH4+)��c(NH3��H2O)=18������c(H+)=10-8mol/L������ҺpHΪ8����Һ�д���HCO3-+H2O= H2CO3+OH-��̼��ĵ��볣����Ka1=4.4��10-7��Ka2=5.6��10-11����֪Kh2= c(H2CO3)��c(OH-)/c(HCO3-)=1��10-14/4.4��10-7������Ϊc(OH-)=10-6mol/L,����c(HCO3-)��c(H2CO3)=44����ȷ����8��44��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д�