题目内容
【题目】工业上可以用废铁屑制备活性Fe3O4,流程如下图:
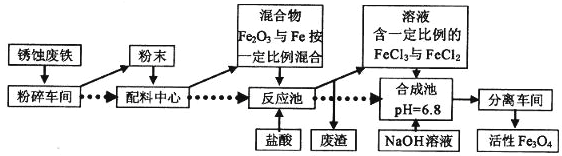
(1)在制备过程中,要将块状固体原料粉碎、磨成粉末,作用是________________________
(2)在合成池里生成Fe3O4的离子方程式为__________________________
(3)假如在反应池中几乎没有气体产生,根据流程可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近________
(4)某同学利用废铁屑(含Fe和Fe2O3)来制取FeCl3·6H2O晶体,同时测定混合物中铁的质量分数,装置如图(夹持装置略,气密性已检验):

操作步骤如下:
I.打开弹簧夹K1、关闭弹簧夹K2,并打开活塞a,缓慢滴加盐酸。
Ⅱ.当……时,关闭弹簧夹K1打开弹簧夹K2,当A中溶液完全进入烧杯后关闭活塞a。
Ⅲ.将烧杯中溶液蒸发浓缩、冷却结晶、过滤后得到FeC13·6H2O晶体。
请回答:
①操作Ⅱ中“……”的内容是______________,烧杯中的现象是________________,相应的方程式是________________、________________。(是离子反应的写离子方程式)
②若混合物质量为m g,实验结束后测得B中所得的气体是V mL(标准状况时),该同学由此计算出此废铁屑中铁的质量分数是![]() ,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
,该数值比实际数值偏低,若实验过程操作无误,偏低的原因是______________________。
【答案】 增大反应物之间的接触面积,增加反应速率,提高生产效率 Fe2++2Fe3++8OH-=Fe3O4↓+4H2O 4:1 当A中固体完全消失 2Fe2++H2O2+2H+=2Fe3++2H2O 2H2O2![]() 2H2O+O2↑ 无色溶液逐渐变黄,有气泡产生 Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
2H2O+O2↑ 无色溶液逐渐变黄,有气泡产生 Fe3+和Fe发生反应消耗部分Fe,使与盐酸反应的Fe相应减少
【解析】(1)固体的表面积越大,反应速率越快,所以在工业生产中,将块状固体磨成粉末,并在反应池中安装搅拌机,目的是增加反应速率;
(2)Fe2+与Fe3+在碱性条件下反应生成Fe3O4,反应的离子方程式为:Fe2++2Fe3++8OH-=Fe3O4↓+4H2O;
(3)没有气体产生,说明铁刚好使三价铁转化为二价铁,由于在1molFe3O4中可以认为有二价的氧化亚铁和三价的三氧化铁各1mol,
设Fe为Xmol,Fe2O3为ymol,生成1molFe3O4,根据Fe+2Fe3+=3Fe2+则有:
X+2Y=3;3X=1
解得X=![]() ;Y=
;Y=![]() ,故Fe2O3与Fe物质的量之比为4:1;
,故Fe2O3与Fe物质的量之比为4:1;
(4)①当A中固体完全消失,铁完全和盐酸反应后,反应结束;当A中溶液完全进入烧杯,生成的氯化亚铁被氧化成黄色的氯化铁,生成的氯化铁作催化剂,使双氧水分解,反应的方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
②由于废铁屑中含有氧化铁,和盐酸反应生成的三价铁离子能够和铁反应,导致铁减少,置换的氢气体积减少。

【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) CH3COOH溶液中,其电离平衡常数表达式为K =_____,常温下测得NaHSO3溶液的pH<7,其原因是_____。
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为_____。
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。