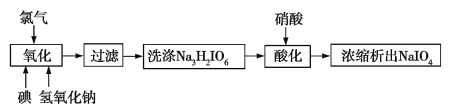
题目内容
【题目】[化学——选修3:物质结构与性质]
已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同。D原子最外层电子数为次外层电子数的3倍。E与D位于同一主族。A、B、D三种元素组成的一种化合物X是新装修居室中常含有的一种有害气体。由A、C、D、E、F五种元素按照原子个数比为14∶4∶5∶1∶1形成的化合物Y为深蓝色晶体。
回答下列问题:
(1) 基态E原子的价电子排布图为_____________________。
(2) 形成化合物Y的五种元素中第一电离能最大的是__________;电负性最大的是________(填元素符号)。
(3) 化合物X中心原子的杂化方式为________,X分子中的两种键角的大小关系是_________________(用∠XYZ表示,X、Y、Z代表元素符号)。
(4) C2D分子的立体结构为________________;A分别与B、C形成的简单化合物熔、沸点由高到低顺序为________(用化学式表示),简单说明原因_________________。
(5) 晶体Y中存在的化学键类型有_____________________。(填代号)
A、离子键 B、非极性共价键 C、配位键 D、氢键 E、σ键 F、金属键
(6) 下图是D、F两种元素形成的化合物的晶胞结构示意图,F的配位数是_______________;已知晶胞中最近的两个D原子间距离为a nm,阿伏伽德罗常数用NA表示,则该晶体的密度为__________g/cm3(用含a、NA的表达式表示)。

【答案】 ![]() N O sp2杂化 ∠OCH大于∠HCH 直线形 NH3>CH4 NH3分子间存在氢键 ACE 2
N O sp2杂化 ∠OCH大于∠HCH 直线形 NH3>CH4 NH3分子间存在氢键 ACE 2 ![]()
【解析】已知A、B、C、D、E、F都是元素周期表中前四周期的元素,它们的核电荷数依次递增。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,B是C。D原子最外层电子数为次外层电子数的3倍,D是O,所以C是N。E与D位于同一主族,E是S。A、B、D三种元素组成的一种化合物X是新装修居室中常含有的一种有害气体,X是甲醛,因此A是H。由A、C、D、E、F五种元素按照原子个数比为14∶4∶5∶1∶1形成的化合物Y为深蓝色晶体,所以F是Cu;则
(1) 基态S原子的核外电子数是16,则价电子排布图为![]() 。(2)由于氮元素的2p轨道电子处于半充满状态,稳定性强,则形成化合物Y的五种元素中第一电离能最大的是N;非金属性越强,电负性越大,则电负性最大的是O。(3)HCHO是平面形结构,则中心原子碳原子的杂化方式为sp2杂化,HCHO分子中由于氧原子上有2对未成键的孤电子对,且为C=O双键,均对C-H键或C-Cl键形成较大的斥力,故HCHO分子中的两种键角的大小关系是∠OCH大于∠HCH。(4) N2O分子和CO2互为等电子体,则立体结构为直线形;由于NH3分子间存在氢键,所以沸点:NH3>CH4。(5) 晶体Y的化学式为[Cu(NH3)4]SO4·H2O,其中存在的化学键类型有离子键、配位键、σ键,答案选ACE;(6)根据晶胞结构可知Cu的配位数是2;已知晶胞中最近的两个O原子间距离为a nm,则晶胞的体对角线是2a nm,晶胞的边长是
。(2)由于氮元素的2p轨道电子处于半充满状态,稳定性强,则形成化合物Y的五种元素中第一电离能最大的是N;非金属性越强,电负性越大,则电负性最大的是O。(3)HCHO是平面形结构,则中心原子碳原子的杂化方式为sp2杂化,HCHO分子中由于氧原子上有2对未成键的孤电子对,且为C=O双键,均对C-H键或C-Cl键形成较大的斥力,故HCHO分子中的两种键角的大小关系是∠OCH大于∠HCH。(4) N2O分子和CO2互为等电子体,则立体结构为直线形;由于NH3分子间存在氢键,所以沸点:NH3>CH4。(5) 晶体Y的化学式为[Cu(NH3)4]SO4·H2O,其中存在的化学键类型有离子键、配位键、σ键,答案选ACE;(6)根据晶胞结构可知Cu的配位数是2;已知晶胞中最近的两个O原子间距离为a nm,则晶胞的体对角线是2a nm,晶胞的边长是![]() ,密度是(
,密度是(![]() ×10-7cm)3,则该晶体的密度为
×10-7cm)3,则该晶体的密度为![]() g/cm3。
g/cm3。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1) CH3COOH溶液中,其电离平衡常数表达式为K =_____,常温下测得NaHSO3溶液的pH<7,其原因是_____。
(2) 常温下,将体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3) 下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为_____。
(4) 体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(5) 已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为_____。