题目内容
8. 如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:
如图表示的是在800℃时,含有A、B、C三种气体的体系中各物质浓度随时间变化的情况,请回答:(1)该反应的反应物是A.
(2)该反应的化学方程式是2A?B+3C.
(3)该反应达到平衡状态的时间为2min,则此时B物质的平均反应速率为0.2mol/(L.min).此时A物质的转化率为40%.
分析 (1)根据图知,随着反应的进行,物质的量浓度减小的物质是反应物、物质的量浓度增大的物质是生成物;
(2)该反应中△c(A)=(2.0-1.2)mol/L=0.8mol/L、△c(B)=(0.4-0)mol/L=0.4mol/L、△c(C)=(1.2-0)mol/L=1.2mol/L,同一反应中同一时间内,各物质物质的量浓度变化量之比等于其计量数之比,所以A、B、C的计量数之比=0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,据此书写方程式;
(3)可逆反应达到平衡状态时各物质的物质的量浓度不变;B的平均反应速率=$\frac{△c}{△t}$;A的转化率=$\frac{△c(A)}{c(A)}$×100%.
解答 解:(1)根据图知,随着反应的进行,物质的量浓度减小的物质是反应物、物质的量浓度增大的物质是生成物,所以A是反应物、B和C是生成物,故答案为:A;
(2)该反应中△c(A)=(2.0-1.2)mol/L=0.8mol/L、△c(B)=(0.4-0)mol/L=0.4mol/L、△c(C)=(1.2-0)mol/L=1.2mol/L,同一反应中同一时间内,各物质物质的量浓度变化量之比等于其计量数之比,所以A、B、C的计量数之比=0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,则该反应方程式为2A?B+3C,
故答案为:2A?B+3C;
(3)可逆反应达到平衡状态时各物质的物质的量浓度不变,根据图知,2min时该反应达到平衡状态;B的平均反应速率=$\frac{△c}{△t}$=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min);A的转化率=$\frac{△c(A)}{c(A)}$×100%=$\frac{0.8mol/L}{2.0mol/L}×100%$=40%,
故答案为:2min;0.2mol/(L.min);40%.
点评 本题考查图象分析,侧重考查学生分析计算能力,明确浓度变化量与计量数关系是解本题关键,知道反应速率、转化率基本公式,题目难度不大.

| A. | 容量瓶内壁沾有水滴没有烘干就进行配制 | |
| B. | 转移液体时有少量洒落 | |
| C. | 量取浓硫酸时仰视刻度线 | |
| D. | 定容摇匀后液面下降再加水 |
①石油分馏时把温度计插入受热的液体中
②用酸性高锰酸钾溶液除去乙炔中含有的H2S
③将苯和溴水混合后加入铁粉制取溴苯
④苯和硝基苯混合物采用分液的方法分离.
| A. | 只有①② | B. | 只有③④ | C. | 只有①③ | D. | ①②③④ |
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 甲烷、乙烯和苯都能与酸性高锰酸钾溶液反应 | |
| C. | 乙酸乙酯和油脂在一定条件下都能水解 | |
| D. | 所有烷烃中都存在碳碳单键 |
| -C═C- | ─C≡C─ | ─CH3 | ─C2H5 |
 如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )
如图装置是实验室里常见的气体发生装置,用该装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | K2SO3粉末 | 浓硫酸 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
(1)做酸碱中和滴定时,还缺少的试剂是蒸馏水和指示剂
(2)小明在做“研究温度对反应速率的影响”实验时,他往两支试管均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于冷水中,记录溶液褪色所需的时间.褪色所需时间tA<tB(填“>”、“=”或“<”).写出该反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.
(3)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.000g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol•L-1KMnO4溶液装入酸式(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液紫红色并没有马上退去.将锥形瓶摇动一段时间后,紫红色才慢慢消失;再继续滴加时,紫红色就很快褪色了,可能原因是反应中生成的Mn2+有催化作用;当滴入最后一滴溶液,由无色变为浅紫色,且半分钟内不褪色,说明达到滴定终点.
③计算:重复上述操作2次,记录实验数据如下表.则消耗KMnO4溶液的平均体积为20.00mL,此样品的纯度为90.00%.(已知H2C2O4的相对分子质量为90)
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视.
 阅读下列实验内容,根据题目要求回答问题:
阅读下列实验内容,根据题目要求回答问题:
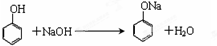 .
. .
.