题目内容
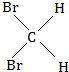
13.工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是( )| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3 (稀)→Cu(NO3)2 | ||
| C. | Cu→CuO→Cu(NO3)2 | D. | Cu→CuSO4→Cu(NO3)2 |
分析 为了节约原料和防止污染环境,则反应中消耗的原料少,且该反应中不生成有毒气体,以此来解答.
解答 解:A.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮有毒而污染环境,所以不符合条件,故A不选;
B.3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,NO有毒会污染环境,所以不符合条件,故B不选;
C.2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CuO+2HNO3=Cu(NO3)2+H2O,该反应中没有有毒气体生成,且能节约硝酸,所以符合条件,故C选;
D.Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O、CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2,该过程中生成有毒气体二氧化硫且浪费浓硫酸、硝酸钡,所以不符合条件,故D不选;
故选C.
点评 本题以硝酸铜制备考查实验方案评价,为高频考点,明确反应条件、反应物的量、反应生成物的性质即可解答,要注意结合节约、环保理念分析解答,题目难度不大.

练习册系列答案
相关题目
4.下列变化过程中,需吸收能量的是( )
| A. | H+H→H2 | B. | H+Cl→HCl | C. | I2→I+I | D. | C+O2→CO2 |
1.下列说法错误的是( )
| A. | 含有离子键的晶体一定是离子晶体 | |
| B. | 离子晶体中一定不含共价键 | |
| C. | Na2O和SiO2的晶体中都不存在单个分子 | |
| D. | 干冰与氖晶体熔化时克服的微粒间的作用力的类型相同 |
8.在密闭容器中发生反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为0.2mol•L-1、0.3mol•L-1和0.2mol•L-1,则平衡时各物质的浓度不可能是( )
| A. | X为0.25 mol•L-1 | |
| B. | Y为0.1 mol•L-1 | |
| C. | Z为0.2 mol•L-1 | |
| D. | Z为0.25 mol•L-1时,Y为0.45 mol•L-1 |
5.苯与乙烯、乙炔相比较,下列叙述不正确的是( )
| A. | 同质量的乙炔和苯完全燃烧生成二氧化碳的质量完全相等 | |
| B. | 都容易发生取代反应 | |
| C. | 苯只能在特殊条件下发生加成反应 | |
| D. | 苯不能被KmnO4所氧化 |
 、
、
 ②酚醛树脂
②酚醛树脂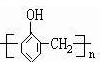 ③TNT
③TNT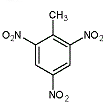
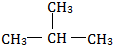 E、
E、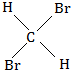 与
与