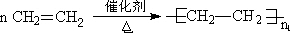题目内容
12.学生设计的用氨催化法制取少量HNO3溶液的实验装置如图所示: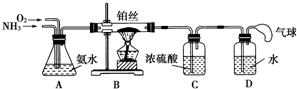
(1)实验室制备NH3,下列方法中适宜选用的是①③(填序号).
①固态氯化铵与熟石灰混合加热 ②固态氯化铵加热分解
③碱石灰中滴加浓氨水 ④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O.
在实验过程中,加热铂丝红热后,移去酒精灯,发现铂丝还继续保持红热,由此可判断该反应是放热(填“吸热”或“放热”)反应.
(3)装置C的作用是吸收未反应的NH3;装置C中的现象是有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;为确保装置D中尽可能多地生成HNO3,所通入O2和NH3的体积比应大于2:1.
(4)装置D中发生的反应化学方程式为3NO2+H2O═2HNO3+NO.
分析 (1)氯化铵加热生成氨气和氯化氢,氯化氢和氨气反应生成氯化铵;氨气易溶于水,稀氨水浓度小,不能制氨气;氯化铵溶液与氢氧化钠溶液共热,能制得氨气但量少,不是实验室制备氨气的方法;实验室用固态氯化铵与氢氧化钙混合加热制备氨气和碱石灰中滴加浓氨水方法制氨气;
(2)氨催化氧化生成一氧化氮和水;移去酒精灯,发现铂丝还继续保持红热,说明反应是放热反应;
(3)装置C浓硫酸的作用是吸收未反应的NH3,装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3,其含义就是NH3通过转化后全部生成HNO3,由4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1;
(4)NO2与H2O反应,生成硝酸和一氧化氮.
解答 解:(1)①固态氯化铵与熟石灰混合加热,是实验室制氨气的主要方法,故正确;
②固态氯化铵加热分解,成氨气和氯化氢,氯化氢和氨气反应生成氯化铵,故错误;
③碱石灰中滴加浓氨水,也是实验室制氨气的方法之一,故正确;
④氯化铵溶液与氢氧化钠溶液共热,能制得氨气但量少,不是实验室制备氨气的方法;
故选:①③;
(2)氨催化氧化生成一氧化氮和水,方程式为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,移去酒精灯,发现铂丝还继续保持红热,说明反应是放热反应,
故答案为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;放热;
(3)装置C浓硫酸的作用是吸收未反应的NH3,装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3,其含义就是NH3通过转化后全部生成HNO3,由4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1,
故答案为:吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1;
(4)NO2与H2O反应,生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,故答案为:3NO2+H2O═2HNO3+NO.
点评 本题是实验室氨气的制备装置和浓硫酸的性质应用,掌握氨气的制备和性质以及掌握氨的催化氧化反应和一氧化氮转化为硝酸的原理是解答的关键,题目难度中等.

| A. | 每生成2mol SO2的同时,消耗2molSO3 | |
| B. | 混合气体的总质量不再变化 | |
| C. | 每生成2mol SO3的同时,消耗1molSO2 | |
| D. | 混合气体的压强不再变化 |
①
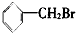 ②
②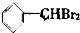 ③
③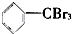 ④
④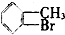 ⑤
⑤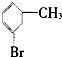 ⑥
⑥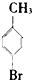 ⑦
⑦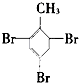
| A. | 仅①②③ | B. | 仅⑦ | C. | 仅④⑤⑥⑦ | D. | 全部 |
| A. | H+H→H2 | B. | H+Cl→HCl | C. | I2→I+I | D. | C+O2→CO2 |
| A. | 含有离子键的晶体一定是离子晶体 | |
| B. | 离子晶体中一定不含共价键 | |
| C. | Na2O和SiO2的晶体中都不存在单个分子 | |
| D. | 干冰与氖晶体熔化时克服的微粒间的作用力的类型相同 |
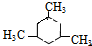 .
.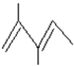 .
.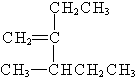 3-甲基-2-乙基-1-戊烯;
3-甲基-2-乙基-1-戊烯;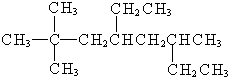 2,2,6-三甲基-4-乙基辛烷.
2,2,6-三甲基-4-乙基辛烷.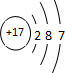 ,元素B在周期表中的位置2周期ⅥA族.
,元素B在周期表中的位置2周期ⅥA族. 、
、