题目内容
4.下列叙述中正确的是( )| A. | 液态HCl、固体NaCl均不导电,所以HCl和NaCl均是非电解质 | |
| B. | NH3、SO3的水溶液均导电,所以NH3、SO3均是电解质 | |
| C. | 常见的酸、碱和大部分盐都是强电解质 | |
| D. | 强电解质与弱电解质的本质区别,是其在水溶液中的电离程度不同 |
分析 电解质是指:在水溶液中或熔融状态下能够导电的化合物.电解质水溶液中或熔融状态下能够导电,是因电解质自身可以离解成自由移动的离子;
非电解质是相对于电解质而言的一个概念,在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质;
电解质的强弱是根据其电离程度判断,完全电离的电解质是强电解质,部分电离的电解质是弱电解质.
解答 解:A.HCl在水溶液中能够导电,所以HCl是电解质,NaCl固体不导电,是由于没有自由移动的离子,但在水溶液中或熔融状态下能电离出自由移动的钠离子和氯离子导电,属于电解质,故A错误;
B.氨气的水溶液导电,但导电的离子是一水合氨电离出的,不是氨气电离出的,因此氨气为非电解质,SO3的水溶液虽然能导电,但导电的离子是三氧化碳和水反应生成的硫酸电离,不是三氧化碳自身电离的,为非电解质,故B错误;
C.常见的强酸、强碱和大部分盐都是强电解质,其他化合物不一定是强电解质,如弱酸、弱碱属于弱电解质,故C错误;
D.强电解质和弱电解质的划分是看在水中是否能够完全电离,完全电离的电解质是强电解质,部分电离的电解质是弱电解质,故D正确;
故选D.
点评 本题考查电解质、非电解质、强弱概念的辨析,题目难度不大.解题时紧抓住电解质必须是化合物,以及导电是在水溶液或熔化状态下为条件,强弱电解质区别为是否能完全电离.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
14.下列晶体熔化时不需要破坏化学键的是( )
| A. | 金刚石 | B. | 氟化镁 | C. | 冰醋酸 | D. | 金属钾 |
12.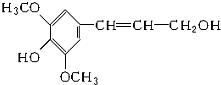 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维.其单体之一--芥子醇结构简式如图所示,下列有关芥子醇的说法正确的是( )| A. | 芥子醇分子中有两种含氧官能团 | |
| B. | 芥子醇分子中所有碳原子不可能在同一平面上 | |
| C. | 1 mol芥子醇与足量浓溴水反应,最多消耗3 mol Br2 | |
| D. | 芥子醇能发生的反应类型有氧化、取代、加成 |
19.下列化学用语正确的是( )
| A. | 氯化钠的电子式: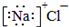 | B. | 氯化氢的电子式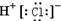 | ||
| C. | 碳元素位于周期表中第2周期ⅥA族 | D. | H2O的结构式:H-O-H |
16.下列关于物质分类的叙述正确的是( )
| A. | 糖类、油脂、蛋白质均为高分子化合物 | |
| B. | 苯、邻二甲苯互为同系物 | |
| C. | 棉、麻、羊毛及合成纤维统称为化学纤维 | |
| D. | 合成聚乙烯与合成酚醛树脂的反应类型相同 |
13.NA为阿伏加德罗常数,下列有关说法正确的是( )
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 4℃时,18g 2H216O中含有共用电子对数为2NA | |
| C. | 1 mol N5+含有的电子数为34NA | |
| D. | 用金属铁、Cu片、稀硫酸组成原电池,当金属铁质量减轻5.6g时,流过外电路的电子为0.3NA |
14.下列各组元素的原子序数中,其相应的元素原子能形成XY2型共价化合物的是( )
| A. | 3与8 | B. | 6与8 | C. | 1与16 | D. | 12与17 |