题目内容
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。请回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用 指示剂,判断到达滴定终点的实验现象是 。
(2)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
②滴定时的正确操作是 。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失 D.滴定前平视读数,滴定结束俯视读数
(1)酚酞(1分);溶液的颜色刚好由浅红变为无色,且半分钟内颜色不变化(1分)
(2)① 31.08 mL (2分) 62.08 (2分)
②左手控制活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化(2分)
③ B C (2分)
解析试题分析:(1)根据题中提供的酸碱指示剂的变色范围可知,只有酚酞的变色在碱性范围内,此时只有NaOH与HCl反应,BaCO3不与HCl反应;原溶液为碱性,酚酞为红色,滴定终点时,红与粉红无明显变化,故非终点,终点应为粉红色变为无色,所以达到终点的现象为:溶液的颜色刚好由浅红变为无色且半分钟内颜色不变化即为滴定终点;
(2)①实验1消耗的盐酸体积为31.00mL,实验2消耗标准液盐酸的体积为:32.04mL-1.00mL=31.04mL,实验3的初读数为1.10mL,末读数为:32.18mL,所以到达滴定终点时所耗HCl溶液的体积为:32.18mL-1.10mL="31.08" mL;滴定数据都是有效的,三次滴定消耗盐酸的平均体积为: mL=31.04mL,待测液氢氧化钠的浓度为:c(待测)=
mL=31.04mL,待测液氢氧化钠的浓度为:c(待测)= =0.3104mol/L,
=0.3104mol/L,
5.0g样品配制成的250mL溶液中含有的氢氧化钠的物质的量为:0.3104mol/L×0.25mol=0.0776mol,
样品中氢氧化钠的质量分数为:ω(NaOH)=×100%=62.08%;
②在中和滴定过程中,滴定时的正确操作为:左手控制活塞,右手不断摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化;
③A.锥形瓶用蒸馏水洗后未用待测液润洗,对待测液物质的量没有影响,不影响滴定结果,故A错误;B.酸式滴定管用蒸馏水洗后未用标准液润洗,导致标准液浓度减小,滴定时消耗的标准液体积偏大,测定结果偏高,故B正确;C.在滴定前有气泡,滴定后气泡消失,导致消耗的标准液体积偏大,测定结果偏高,故C正确;D.滴定前平视读数,滴定结束俯视读数,导致读出的标准液体积偏小,测定结果偏低,故D错误;故选BC。
考点:考查酸碱中和实验的有关判断、误差分析。

某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下: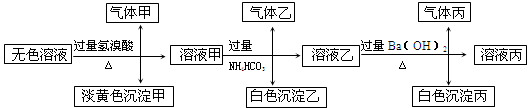
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是 。
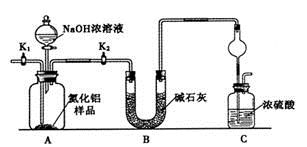
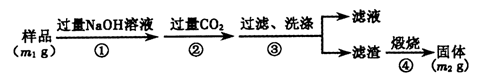
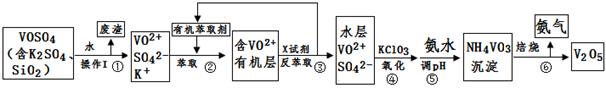
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含 量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为 。
某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20ml甲醇(密度约0.79g·mL-1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。‘
(1)浓硫酸的作用是 ;
|
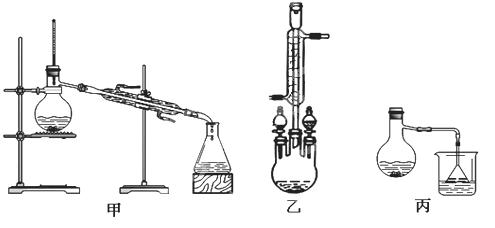
Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ 操作Ⅱ 。
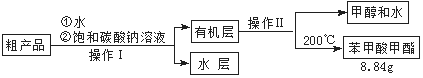
(4)能否用NaOH溶液代替饱和碳酸钠溶液? (填“能”或“否”),
并简述原因 。
(5)通过计算,苯甲酸甲酯的产率是 。
 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)  都看作
都看作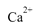 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的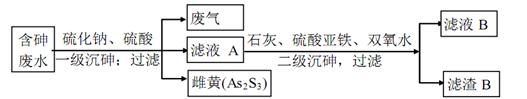

 Na2S2O3(aq)
Na2S2O3(aq)