题目内容
氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。
已知:AlN+NaOH+H2O=NaAlO2+NH3↑
【方案1】
取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图C装置中球形干燥管的作用是_____________。
(2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是______________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是______________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见___________。
【方案2】
用右图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_____________。
a.CCl4 b.H2O c.NH4Cl溶液 d.
(5)若m g样品完全反应,测得生成气体的体积为V mL(已转换为标准状况),则AIN的质量分数 。
【方案3】按以下步骤测定样品中A1N的纯度:
(6)步骤②生成沉淀的离子方程式为___________________。
(7)若在步骤③中未洗涤,测定结果将______(填“偏高”、“偏低”或“无影响”)。
(1)防止发生倒吸
(2)检查装置气密性;关闭K1,打开K2;把装置中残留的氨气全部赶入C装置中。
(3)C装置出口处连接一个干燥装置
(4)ad
(5)41/22400m
(6)AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓
(7)偏高
解析

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。请回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,应选用 指示剂,判断到达滴定终点的实验现象是 。
(2)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·L-1的盐酸标准液进行滴定,相关数据记录如下:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
②滴定时的正确操作是 。
③下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗 B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴定前有气泡,滴定后气泡消失 D.滴定前平视读数,滴定结束俯视读数
14 分苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为: 
已知:
| 名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
| 苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
| 苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
实验步骤如下:
①在圆底烧瓶中加入4.0g苯甲酸,10 mL 95%的乙醇(过量),8mL 环己烷以及3 mL 浓硫酸,混合均匀并加入沸石,按右图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。

②反应一段时间,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为2.3mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①加入沸石的作用是 。如果加热一段时间后发现忘记加沸石,应该采取的正确操作是:
(3)步骤①中使用分水器不断分离除去水的目的是
(4)步骤③加入Na2CO3加入不足,在之后蒸馏时蒸馏烧瓶中可见到白烟生成,产生该现象的原因 ;
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须
(6)计算本实验的产率为 。
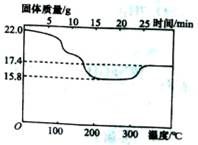
(14分)锰锌软磁铁氧体具有高磁导率、低矫顽力和低功率损耗等性能,已广泛应用于电子工业。碳酸锰主要用于制备锰锌软磁铁氧体,而制碳酸锰的原料之一是二氧化锰。某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为MnO2)洗涤、过滤、烘干。
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入Na2CO3溶液,边加边搅拌,再过滤即可得到碳酸锰。
(l)在第②步中,将上述固体与浓盐酸混合的目的是
(2)有人认为,将第③步中的Na2CO3溶液换成NH4HCO3溶液,也能达到上述目的,但同时有气体生成。请写出加入NH4HCO3溶液时发生的离子反应方程式 。
(3)查阅文献,发现第③步中,除生成MnCO3外还有可能生成Mn(OH)2,已知Mn(OH)2暴露在空气中时间稍长,易被氧化成褐色的MnO(OH)2, MnCO3和MnO(OH)2受热最终均分解成MnO2,该小组对上述沉淀的成分提出以下假设,请帮助完成假设:
假设一:全部为MnCO3; 假设二:全部为Mn(OH)2; 假设三:
为验证假设二是否正确,该小组进行了以下研究:
①定性研究:请你完成下表中的内容.
| 实验步骤(不要求写出具体步骤) | 预期的实验现象和结论 |
| 将所得沉淀过滤、洗涤, | |
| | |
硫代硫酸钠(Na2S2O3)俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
Na2S2O3易溶于水,不溶于乙醇,常温下溶液中析出晶体通常为Na2S2O·5H2O。实验室制备保险粉的装置如下图所示。涉及的总化学方程式如下: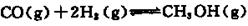

(1)检查虚线框内装置气密性的方法是 。
(2)反应前仪器a中加入的药品为 ,仪器c中加入的药品为 。
(3)仪器b的名称是 。
(4)在制备过程中,持续通人气体时,观察到B装置中先有大量浅黄色沉淀析出,反应一段时间,沉淀逐渐减少;待浅黄色沉淀消失时反应完成,停止加热。反应的离子方程式为 。
(5)反应完成后,为了从混合溶液中获取产品,操作如下:
操作②为 。
(6)为了测产品的纯度,称取8.000 g粗产品,配制成250 mL溶液,用移液管移取25.00 mL于锥形瓶中,再用0.05000 mol·L-l的碘标准溶液进行滴定(2S2O32-+I2=S4O62-+2I-),
平行3次实验,平均消耗碘标准溶液的体积为30.00mL。
①测得产品的纯度为 。
②关于上述实验的有关操作,以下表述正确的是 。(填编号)
| A.用碱式滴定管盛装碘标准溶液 |
| B.用移液管移取25.00mL溶液于锥形瓶中,移液管的尖嘴和锥形瓶内壁要接触 |
| C.如果滴定终点没有控制好,碘标准溶液滴加过量,则必须重新进行滴定 |
| D.滴定过程中若剧烈摇动锥形瓶(溶液不外溅),则所测得的纯度将会偏高 |
发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由 组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象: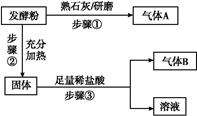
(2)结合步骤①~③分析,气体A为 ,该发酵粉的成分为 (填化学式)。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由: 。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请你设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/L NaOH溶液
写出实验步骤、预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后,将溶液分成两份,分别装入A、B试管中 | |
| 步骤2: | ,证明有Na+,发酵粉中有NaHCO3 |
| 步骤3: | ,结合步骤2中的结论,假设2成立 |


 )如下:
)如下: (水杨酸)+SOCl2→
(水杨酸)+SOCl2→ (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
 ),温度控制在100℃左右,不断搅拌。
),温度控制在100℃左右,不断搅拌。