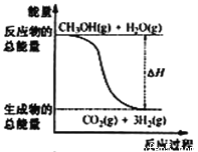
��Ŀ����
����Ŀ����Na2CO3��NaAlO2�Ļ����Һ����μ���150mL 1molL��1 HCl��Һ�������Һ�е�ij�����������ʵ����ı仯��ͼ��ʾ��������˵������ȷ���ǣ� �� 
A.a���߱�ʾ�����ӷ���ʽΪ��AlO2��+H++H2O�TAl��OH��3��
B.b��c���߱�ʾ�����ӷ�Ӧ����ͬ��
C.M��ʱ����Һ�г���������Ϊ3.9g
D.ԭ�����Һ�е�CO32����AlO2�������ʵ���֮��Ϊ1��2
���𰸡�D
���������⣺Na2CO3��NaAlO2�Ļ����Һ�м���HCl��Һ���ȷ�����ӦAlO2��+H++H2O�TAl��OH��3����a�߱�ʾAlO2�����٣��ڶ��Σ�AlO2����Ӧ��ϣ�������ӦCO32��+H+�THCO3�� �� b�߱�ʾCO32�����٣�c�߱�ʾHCO3�������ӣ������Σ�CO32����Ӧ��ϣ�������ӦHCO3��+H+�TCO2��+H2O��d�߱�ʾHCO3�����٣��˽�Al��OH��3�����뷴Ӧ�� A��Na2CO3 �� NaAlO2�Ļ����Һ�м���HCl��Һ���ȷ�����Ӧ��AlO2��+H++H2O�TAl��OH��3������A��ȷ��
B���ڶ��Σ�AlO2����Ӧ��ϣ�������Ӧ��CO32��+H+�THCO3�� �� b�߱�ʾCO32�����٣�c�߱�ʾHCO3�������ӣ�����b��c���߱�ʾ�����ӷ�Ӧ����ͬ�ģ���B��ȷ��
C������50mLʱNaAlO2����Ԫ��ȫ��ת��Ϊ����������������50mL����֮��CO32����Ӧ�����������������ܽ⣬��M�����������������50mLʱ������������ͬ����NaAlO2+HCl+H2O=NaCl+Al��OH��3��֪��n��Al��OH��3��=n��NaAlO2��=n��HCl��0.05mol��m[Al��OH��3]=0.05mol��78g/mol=3.9g����C��ȷ��
D����һ���ڶ��������ĵ�������������50ml���������ĵ��Ȼ�������ʵ�����ȣ����ݵ�һ�Ρ��ڶ��η�����ӦAlO2��+H++H2O�TAl��OH��3����CO32��+H+�THCO3�� �� ��֪CO32����AlO2�������ʵ���֮��Ϊ1��1�������������ʶ���ǿ�������ζ���ˮ�⣬ˮ��̶Ȳ�ͬ�������ж���Һ��CO32����AlO2�������ʵ���֮�ȣ���D����
��ѡD��

 ��У����ϵ�д�
��У����ϵ�д�