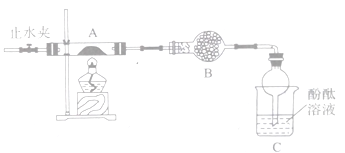
题目内容
【题目】焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈.发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X.
(1)根据题意,可判断出X是(写化学式).
(2)写出并配平该反应的化学方程式:;
(3)发生还原反应的物质是 , 反应中2mol的氧化剂能(填“失去”或“得到”)mol电子.
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为 .
【答案】
(1)H2O
(2)6NH4Cl+4Fe2O3=6Fe+2FeCl3+3N2↑+12H2O
(3)Fe2O3;得到;12
(4)40g
【解析】解:(1)根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3 , 则该反应得生成物为FeCl3、N2、Fe和X,根据元素守恒可知X中含有H、O元素,则X为H2O,所以答案是:H2O;(2)由反应物和生成物可知,NH4Cl+Fe2O3→Fe+FeCl3+N2↑+H2O,该反应Fe元素的化合价由+3价降低为0,N元素的化合价由﹣3价升高到0,根据电子守恒可知,得电子数=失去电子数=18e﹣ , 则6NH4Cl+Fe2O3→6Fe+FeCl3+3N2↑+H2O,再质量守恒定律可知,配平的化学反应为6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O,所以答案是:6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O;(3)反应6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O中,N元素化合价升高,被氧化,Fe元素化合价降低,由+3价降低到0价,被还原,Fe2O3为氧化剂,由方程式可知,当4molFe2O3参加反应时,有6mol被还原,如2molFe2O3部被还原,应得到12mol电子,所以答案是:Fe2O3;得到;12;(4)11.2L(标准状况)的气体,其物质的量为 ![]() =0.25mol,由6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O可知,气体与起氧化剂作用的氧化铁得关系为,3N2~3Fe2O3 , 则被还原的物质的质量为0.25mol×160g/mol=40g,所以答案是:40g.
=0.25mol,由6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O可知,气体与起氧化剂作用的氧化铁得关系为,3N2~3Fe2O3 , 则被还原的物质的质量为0.25mol×160g/mol=40g,所以答案是:40g.

【题目】铁及碳的化合物在社会生产、生活中有着广泛的应用.请回答下列问题:
(1)磁铁矿是工业上冶炼铁的原料之一.
已知:①Fe3O4(s)+ 4C(s)![]() 3Fe(s)+ 4CO(g) △H=+646.0kJ·mol﹣1
3Fe(s)+ 4CO(g) △H=+646.0kJ·mol﹣1
②C(s)+ CO2(g)![]() 2CO(g) △H=+172.5kJ·mol﹣1
2CO(g) △H=+172.5kJ·mol﹣1
则Fe3O4(s)+ 4CO(g)![]() 3Fe(s)+ 4CO2(g) △H=________________.
3Fe(s)+ 4CO2(g) △H=________________.
(2)反应Fe(s)+ CO2(g)![]() FeO(s)+ CO(g) △H的平衡常数为K,在不同温度下,K值如下:
FeO(s)+ CO(g) △H的平衡常数为K,在不同温度下,K值如下:
温度/K | 973 | 1173 | 1373 | 1573 |
K | 1.47 | 2.15 | 3.36 | 8.92 |
①从表中数据可推断,该反应是___________(填“放热”或“吸热”)反应.
②温度为973K时,在某恒容密闭容器中发生上述反应.下列有关说法能说明该反应已达到平衡状态的是_____________(填字母).
A.c(CO2)= c(CO) B.v正(CO2)= v逆(CO)
C.体系压强不变 D.混合气体中c(CO)不变
(3)如图图1、2表示反应:H2(g)+ CO2(g)![]() CO(g)+ H2O(g)△H>0有关量与反应时间之间的关系:
CO(g)+ H2O(g)△H>0有关量与反应时间之间的关系:

①图2中,若t1=0.5min,则0~t1时间段内,H2O的平均反应速率v(H2O)=____mol·L﹣1·min ﹣1。
②图1中t2时刻改变的条件是________________________________(任写两种,下同);图2中t2时刻改变的条件是_________________________________.
(4)水煤气中的CO和H2均可作为燃料电池的燃料.若在某燃料电池一极通入CO,另一极通入O2和