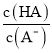题目内容
【题目】下列离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2=Fe3++2H2O
C.Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
D.向含 0.5 mol的FeBr2溶液中通入13.44L(标准状况下)Cl2:10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl-
【答案】D
【解析】
A.硝酸具有强氧化性,向稀HNO3中滴加Na2SO3溶液的离子反应为2NO3-+3SO32-+2H+=3SO42-+2NO↑+H2O,故A错误;
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液的离子反应为2Fe2++2H++H2O2═2Fe3++2H2O,故B错误;
C.Mg(HCO3)2溶液中加入过量石灰水反应生成氢氧化镁、碳酸钙和水,反应的离子方程式为Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓,故C错误;
D.13.44L(标准状况下)Cl2的物质的量为![]() =0.6mol,向含0.5mol的FeBr2溶液中通入0.6molCl2,亚铁离子全被氧化,溴离子部分被氧化,反应的离子方程式为10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl-,故D正确;
=0.6mol,向含0.5mol的FeBr2溶液中通入0.6molCl2,亚铁离子全被氧化,溴离子部分被氧化,反应的离子方程式为10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl-,故D正确;
故选D。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
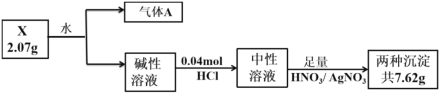
轻巧夺冠周测月考直通高考系列答案【题目】某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________________;并用简单的装置图来表明你所阐述的理由______________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有_______________;
(3)下列物质的加入能减慢氢气生成速率但不影响生成氢气的体积的是_____
A.加入碳酸钠溶液 B.加入硫酸钠溶液
C.加入硝酸钠溶液 D.加入醋酸钠溶液
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验 | 1 | 2 | 3 | 4 | 5 | 6 |
4mol·mol-1H2SO4/mL | 40 | V1 | V2 | V3 | V4 | V5 |
饱和 CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V6、V8 分别是_____________;
②该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会大大提高,随着加入的 CuSO4 溶液增多时,生成氢气的速率会______(填加快、减慢或不变)。理由___________________。
【题目】在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
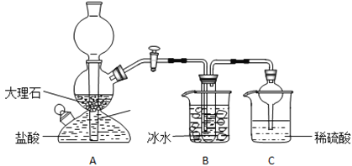
(1)A装置中所发生反应的离子方程式为:_________________。C装置中稀硫酸的作用为:________________。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水是因为________________。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 ______装置____之间(填写字母)连接一个盛有_________ 的洗气装置,其作用是___________
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体。请通过简单实验判断该晶体是碳酸氢钠晶体而不是碳酸氢铵晶体,简述操作方法、实验现象及结论:______________。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.88g,则NaHCO3的产率为__________。