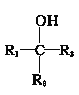
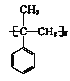
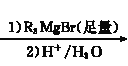题目内容
【题目】在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3↓,依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
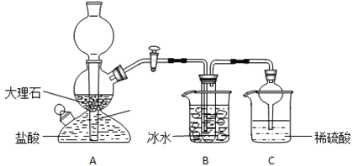
(1)A装置中所发生反应的离子方程式为:_________________。C装置中稀硫酸的作用为:________________。
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析B装置中使用冰水是因为________________。
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 ______装置____之间(填写字母)连接一个盛有_________ 的洗气装置,其作用是___________
(4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体。请通过简单实验判断该晶体是碳酸氢钠晶体而不是碳酸氢铵晶体,简述操作方法、实验现象及结论:______________。
(5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.88g,则NaHCO3的产率为__________。
【答案】CaCO3+2H+=Ca2++CO2↑+H2O 吸收从B装置中的试管内逸出的氨气,减少对环境的污染 温度越低,碳酸氢钠的溶解度越小,便于析出 A B 饱和NaHCO3溶液 除去CO2中混有的HCl气体 取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3 70%
【解析】
A装置是制备二氧化碳气体的装置;B装置中的试管内是溶有氨和氯化钠的饱和溶液,氨水易挥发,C装置是尾气处理装置,据此分析解答。
(1)A装置是制取二氧化碳气体的装置,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O;C装置稀硫酸是尾气处理装置吸收挥发出来的的氨气,防止污染环境,故答案为:CaCO3+2H+=Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出的氨气,减少对环境的污染;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,依据表格数据分析可知温度越低,碳酸氢钠的溶解度越小,所以温度越低,越有利于碳酸氢钠的晶体析出,故答案为:温度越低碳酸氢钠溶解度越小,便于析出;
(3)盐酸易挥发,制得的二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以得不到碳酸氢钠晶体,需要在A与B之间加一个洗气装置,用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体,故答案为:A;B;饱和NaHCO3溶液;除去CO2中混有的HCl气体;
(4)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,反应为:2NaHCO3 ![]() Na2CO3+H2O+CO2↑,有白色固体碳酸钠剩余,碳酸氢铵(NH4HCO3)受热分解,生成氨气(NH3)、二氧化碳和水,反应的化学方程式为:NH4HCO3
Na2CO3+H2O+CO2↑,有白色固体碳酸钠剩余,碳酸氢铵(NH4HCO3)受热分解,生成氨气(NH3)、二氧化碳和水,反应的化学方程式为:NH4HCO3 ![]() NH3↑+CO2↑+H2O,无固体剩余,所以判断该晶体是碳酸氢钠晶体而不是碳酸氢铵晶体的方法为:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3,故答案为:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3;
NH3↑+CO2↑+H2O,无固体剩余,所以判断该晶体是碳酸氢钠晶体而不是碳酸氢铵晶体的方法为:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3,故答案为:取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还有白色固体剩余,则晶体不是NH4HCO3;
(5)饱和食盐水中含NaCl的质量为5.85g,依据化学方程式计算NH3+CO2+NaCl+H2O=NH4Cl+NaHCO3(晶体),理论得到碳酸氢钠质量为8.4g。实验后得到干燥的NaHCO3晶体的质量为5.88g,则碳酸氢钠的产率=![]() ×100%=70%,故答案为:70%。
×100%=70%,故答案为:70%。