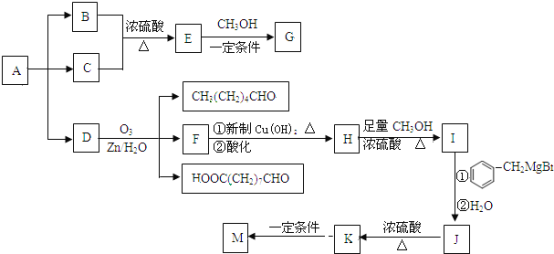
题目内容
【题目】化合物X由三种元素(其中一种是第四周期元素)组成,现进行如下实验:

已知:气体A在标准状况下密度为0.714 g·L-1;碱性溶液焰色反应呈黄色。
(1)X中非金属元素的名称为__________,X的化学式__________。
(2)X与水反应的化学方程式为_________。
(3)化合物Y由X中金属元素和第四周期元素构成,设计实验证明Y的晶体类型__________。
(4)补充焰色反应的操作:取一根铂丝,________,蘸取待测液灼烧,观察火焰颜色。
【答案】碳、溴 Na5CBr Na5CBr+4H2O=4NaOH+NaBr+CH4↑ 将Y加热至熔化,然后测其导电性,若熔融状态下能导电,证明该物质是由离子构成的离子晶体 放在稀盐酸中洗涤后在酒精灯火焰上灼烧至无色
【解析】
X与水反应产生气体A和碱性溶液,气体A摩尔质量为M=0.714 g·L-1×22.4 L/mol=16 g/mol,则A是CH4,说明X中含有C元素;碱性溶液焰色反应呈黄色,说明碱性溶液含有钠元素,物质X中有钠元素;向该碱性溶液中加入0.04 mol HCl溶液显中性后,再加入足量HNO3酸化,再加入AgNO3溶液产生两种沉淀,质量和为7.62 g,根据Cl-守恒,其中含有AgCl沉淀质量为m(AgCl)=0.04 mol×143.5 g/mol=5.74 g,X中含有的另外一种元素位于第四周期,可以与Ag+反应产生沉淀,则该元素为溴元素,则X的组成元素为Na、C、Br三种元素,形成的沉淀为AgBr,其质量为m(AgBr)= 7.62 g-5.74 g=1.88 g,n(AgBr)=1.88 g ÷188 g/mol=0.01 mol,X中含有Br-0.01 mol,其质量为0.01 mol×80 g/mol=0.80 g,结合碱性溶液中加入0.04 mol HCl,溶液显中性,说明2.07gX中含有0.05 molNa+,X与水反应产生0.01 mol HBr和0.05 mol NaOH,其中0.01 mol HBr 反应消耗0.01 mol NaOH,产生0.01 mol NaBr,还有过量0.04 molNaOH,则X中含有C的物质的量为n(C)=(2.07 g-0.05 mol×23 g/mol-0.80 g)÷12 g/mol=0.01 mol,n(Na):n(Br):n(C)=0.05:0.01:0.01=5:1:1,则X化学式为Na5CBr,Na5CBr与水反应总方程式为:Na5CBr+4H2O=4NaOH+NaBr+CH4↑,据此分析解答。
根据上述分析可知X是Na5CBr,A是CH4,碱性溶液为NaOH与NaBr按4:1混合得到的混合物,中性溶液为NaCl、NaBr按4:1物质的量的比的混合物,沉淀为AgCl、AgBr混合物,二者物质的量的比为4:1;
(1)X化学式为Na5CBr,其中非金属元素的名称为碳、溴;
(2)X与水反应的化学方程式为Na5CBr+4H2O=4NaOH+NaBr+CH4↑;
(3)化合物Y由X中金属元素和第四周期元素构成,则Y为NaBr,该化合物为离子化合物,证明Y的晶体类型实验是:将NaBr加热至熔化,测其导电性,若熔融状态下能导电,证明在熔融状态中含有自由移动的离子,则该物质是由离子构成的离子化合物;
(4)补充焰色反应的操作:取一根铂丝,放在稀盐酸中洗涤后在酒精灯或酒精喷灯火焰上灼烧至无色,然后蘸取待测液灼烧,观察火焰颜色,来确定其中含有的金属元素。