题目内容
【题目】现有金属单质A、B和气体甲、乙、丙以及物质C、D、E、F,它们之间能发生如图反应。(图中有些反应的产物和反应条件没有标出)
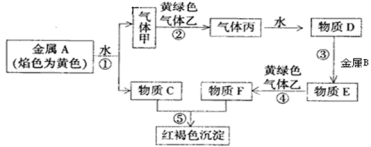
请回答下列问题:
(1)丙的化学式为____。
(2)A的一种氧化物为淡黄色固体,该物质的电子式为___。
(3)写出气体乙与C溶液反应的离子方程式:____。
(4)若将C溶液与E溶液混合,则可以观察到的现象是:____。
(5)配制F溶液时,要将F固体先溶于较浓的盐酸中,再加水稀释,其目的是___(用简单文字和离子方程式说明)。
(6)设计一种检验物质E溶液中金属阳离子实验方案:____(写出实验步骤,现象和结论)。
【答案】HCl ![]() Cl2+2OH-=Cl-+ClO-+H2O 白色沉淀迅速变为灰绿色,最后变为红褐色 抑制Fe3+水解,Fe3++3H2O
Cl2+2OH-=Cl-+ClO-+H2O 白色沉淀迅速变为灰绿色,最后变为红褐色 抑制Fe3+水解,Fe3++3H2O![]() Fe(OH)3+3H+ 取少量的E溶液于试管中滴加K3[Fe(CN)6],若出现蓝色沉淀,则说明金属阳离子为Fe2+
Fe(OH)3+3H+ 取少量的E溶液于试管中滴加K3[Fe(CN)6],若出现蓝色沉淀,则说明金属阳离子为Fe2+
【解析】
金属A焰色反应为黄色,故A为金属Na,乙是黄绿色气体,乙为Cl2,红褐色沉淀为Fe(OH)3,由反应①Na→气体甲+C,为Na与水的反应,生成甲为H2,C为NaOH,H2和Cl2反应生成气体丙,丙为HCl,D为盐酸溶液,由HCl+金属B→E可知,B为金属Fe,E为FeCl2,FeCl2与Cl2反应生成F,则F为FeCl3。据此解答。
(1)由上面的分析可知,丙的化学式为HCl;故答案为HCl;
(2)A的一种氧化物为淡黄色固体,为过氧化钠,该物质的电子式为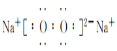
答案为: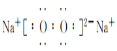
(3)Cl2与NaOH溶液反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-=Cl- +ClO-+H2O;答案为:Cl2+2OH-=Cl- +ClO-+H2O;
(4)若将NaOH溶液与FeCl2溶液混合发生反应生成氢氧化亚铁白色沉淀,氢氧化亚铁在空气中不稳定,白色沉淀迅速变为灰绿色,最后变为红褐色;答案为:白色沉淀迅速变为灰绿色,最后变为红褐色;
(5)FeCl3为强酸弱碱盐,Fe3+发生水解生成Fe(OH)3:Fe3++3H2O![]() Fe(OH)3+3H+,先加入较浓的盐酸可抑制Fe3+水解;答案为:抑制Fe3+水解,Fe3++3H2O
Fe(OH)3+3H+,先加入较浓的盐酸可抑制Fe3+水解;答案为:抑制Fe3+水解,Fe3++3H2O![]() Fe(OH)3+3H+;
Fe(OH)3+3H+;
(6)检验物质FeCl2溶液中Fe2+方法为:取少量的E溶液于试管中滴加K3[Fe(CN)6],若出现蓝色沉淀,则说明金属阳离子为Fe2+;答案为:取少量的E溶液于试管中滴加K3[Fe(CN)6],若出现蓝色沉淀,则说明金属阳离子为Fe2+。

【题目】某温度下2 L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示。
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
下列说法正确的是( )
A. 升高温度,若W的体积分数减小,则此反应ΔH>0
B. 该温度下,此反应的平衡常数K=6.75
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向该容器中加入1.5 mol W,达到新平衡时,c(X)=0.25 mol·L-1