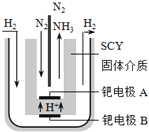
题目内容
【题目】某溶液中可能含有OH-、AlO2-、SiO32-、CO32-、SO42-、K+、Na+、Fe3+、Mg2+、Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
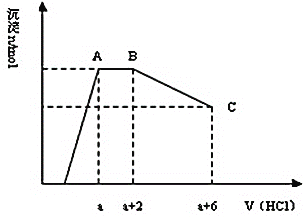
A.原溶液中一定含有Na2SO4
B.反应后形成的溶液溶质为NaCl
C.原溶液中含有CO32-与AlO2-的物质的量比为3:4
D.原溶液中一定含有的离子是OH-、AlO2-、SiO32-、CO32-、K+
【答案】C
【解析】
根据图像分析得出开始阶段是H+和OH-的反应,说明溶液中有OH-,则说明原溶液中没有Fe3+、Mg2+、Al3+,一定含有K+和Na+其中一种或者两种;随后是生成沉淀的阶段,能够与H+反应生成沉淀的,有SiO32-和AlO2-;AB为水平线,沉淀质量不变,说明有气体生成,说明含有CO32-,BC是沉淀减少的阶段,说明有以沉淀能够溶于盐酸,则沉淀中含有Al(OH)3,但是沉淀没有完全消失,最后沉淀为硅酸。
A、根据以上分析原溶液中不一定含有Na2SO4,故A错误;
B、反应后形成的溶液溶质可能为NaCl或KCl,故B错误;
C、根据图像CO32-消耗2体积盐酸,沉淀Al(OH)3消耗4体积盐酸,CO32- + 2 H+ = CO2↑+ H2O,Al(OH)3 + 3 H+ = Al3+ + 3H2O,原溶液中含有CO32-与AlO2-的物质的量比为1: ![]() =3:4,故C正确;
=3:4,故C正确;
D、原溶液中一定含有的离子是OH-、AlO2-、SiO32-、CO32-,而可能含有K+,故D错误;
答案为C。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】为探究FeCl3溶液中的离子平衡和离子反应,某小组同学进行了如下实验。
(1)配制50 mL 1.0 mol·L1的FeCl3溶液,测其pH约为0.7,即c(H+) = 0.2 mol·L1。
① 用化学用语解释FeCl3溶液呈酸性的原因: 。
② 下列实验方案中,能使FeCl3溶液pH升高的是 (填字母序号)。
a. 加水稀释 b. 加入FeCl3固体
c. 滴加浓KSCN溶液 d. 加入NaHCO3固体
(2)小组同学利用上述FeCl3溶液探究其与足量锌粉的反应。实验操作及现象如下:
操作 | 现象 |
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 mol·L1的FeCl3溶液,搅拌 | 溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体 |
收集检验反应过程中产生的气体 | 集气管口靠近火焰,有爆鸣声 |
已知:Zn的性质与Al相似,能发生反应:Zn + 2NaOH = Na2ZnO2 + H2 ↑
① 结合实验现象和平衡移动原理解释出现红褐色沉淀的原因: 。
② 用离子方程式解释反应后溶液为浅绿色的原因: 。
③ 分离出黑色固体,经下列实验证实了其中含有的主要物质。
i. 黑色固体可以被磁铁吸引;
ii. 向黑色固体中加入足量的NaOH溶液,产生气泡;
iii. 将ii中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
iv. 向iii反应后的溶液中滴加KSCN溶液,无变化。
a. 黑色固体中一定含有的物质是 。
b. 小组同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是 。
(3)为进一步探究上述1.0 mol·L1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,继续实验并观察到反应开始时现象如下:
操作 | 现象 |
将5 mL 1.0 mol·L1的FeCl3溶液与0.65 g锌粉混合 | 溶液温度迅速上升,开始时几乎没有气泡 |
将 与0.65 g锌粉混合 | 溶液中立即产生大量气泡 |
小组同学得出结论:在1.0 mol·L1 FeCl3溶液中,Fe3+的氧化性比H+更强。