��Ŀ����
����Ŀ����Ҫ�����
I��NaNO2 ����ۺ�ʳ�����ƣ�������ζ������ʹ����ʳ�ж�����֪ NaNO2�ܷ�����Ӧ��2NaNO2��4HI=2NO����I2��2NaI��2H2O��
��1��������Ӧ���������� ________��
��2������������Ӧ������ NaNO2 �� NaCl����ѡ�õ������Т�ˮ���ڵ⻯��������ֽ�۵��ۡ��ܰơ���ʳ�ף�����Ϊ����ѡ�õ�������________(�����)��
��3������ƽ���»�ѧ����ʽ��____Al��____NaNO3��____ NaOH= ____NaAlO2��____ N2����___H2O��________________������Ӧ������ת�� 5 mol ���ӣ������ɱ�״���� N2 �����Ϊ_________L��
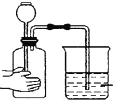
II����100mL1.5mol/L������������Һ�л���ͨ��һ������CO2����Ӧ����������Һ����λ����μ�һ��Ũ�ȵ����ᣬ���������������������������������������ܽ���ˮ����ϵ��ͼ��ʾ��
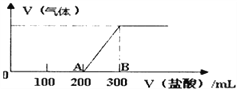
��:������������Һ��һ������CO2��ַ�Ӧ�����Һ������Ϊ____��д��ѧʽ����
�������Ũ��Ϊ_______��
��B��ʱ�������������ڱ�״���µ����Ϊ_______L��
���𰸡�NaNO2 �ڢ� 10 6 4 10 3 2 11.2 NaOH��Na2CO3 0.5mol/L 1.12
��������
���ݻ��ϼ۱仯�ж��������ͻ�ԭ�������ݵ�ʧ�����غ���ƽ������ԭ��Ӧ����ʽ������ͼ���е�����������Һ�����ʵ���ɣ��������ݷ���ʽ������ҺŨ�ȡ�
I����1���õ��ӵķ�Ӧ�������������õ��ӻ��ϼ۽��ͣ�����������Ӧ���������� NaNO2��
�ʴ�Ϊ��NaNO2��
��2�����������2NaNO2��4HI=2NO����I2��2NaI��2H2O��ʾ��������Һ��NaNO2�����������������ɵ��ʵ⣬���Լ���NaNO2 �� NaCl����ѡ�õ������Тڵ⻯��������ֽ�͢�ʳ�ף��ʴ�Ϊ���ڢݣ�
��3�����ݵ�ʧ�����غ���ƽ��ѧ����ʽΪ��10Al��6NaNO3��4NaOH=10NaAlO2��3N2����2H2O������ʽ�е�Ԫ�ػ��ϼ���+5����Ϊ0����������Ӧ������ת�� 5 mol ���ӣ�������0.5mol N2 �����״���µ��������Ϊ11.2L��
�ʴ�Ϊ��10,6,4,10,3,2��11.2��
II������ͼ��ʾ���ռ�������ʱ��δ���������ɣ�˵���������ƹ�����CO2��������NaOH��Ӧ������Na2CO3������δ��Ӧ��NaOH������Һ������ΪNaOH��Na2CO3��
�ʴ�Ϊ��NaOH��Na2CO3��
�ڼ�������200mLʱ��ʼ�������壬����������300mLʱ���ٲ������壬A��B�η���NaHCO3+HCl�TNaCl+H2O+CO2������O-A�����ĵ�����ΪA��B�Ķ�������Ӧ����ӦΪNaOH��Na2CO3�Ļ������߶��������ᷴӦ����Ӧ�����ӷ���ʽ�ֱ�Ϊ��OH-+H+�TH2O��CO32-+H+�THCO3-��B��ʱ��Һ�е����ʽ���NaCl������ԭ���غ�ã�c(HCl)0.3L=0.1L��1.5mol/L����c(HCl)=0.5mol/L��
�ʴ�Ϊ0.5 mol/L��
��AB������HClΪ0.1L��0.5mol/L=0.05mol����NaHCO3+HCl�TNaCl+H2O+CO2������֪���ɶ�����̼�����ʵ���Ϊ0.05mol�������0.1mol������̼�����Ϊ��22.4L/mol��0.05mol=1.12L��
�ʴ�Ϊ��1.12��

 �̲�ȫ���ִʾ�ƪϵ�д�
�̲�ȫ���ִʾ�ƪϵ�д�����Ŀ������������ʵ�飬�䷽����ƺ�������
A | B | C | D |
����װ�������� | �ƹ������� | ��֤ŨH2SO4����ˮ�ԡ�ǿ������ | �Ƚ�NaHCO3��Na2CO3�ܽ�� |
|
|
|
|
A. A B. B C. C D. D
����Ŀ���ס��ҡ���������Ϊ��ѧ��ѧ�����Ĵ��������֮��������ͼ��ʾ�ķ�Ӧ��ϵ�����������鲻��������ת����ϵ����
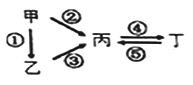
ѡ�� | �� | �� | �� | �� |
A | Fe | FeCl2 | FeCl3 | Fe(OH)3 |
B | Si | SiO2 | Na2SiO3 | Na2CO3 |
C | Na | Na2O | Na2O2 | NaOH |
D | Al | Al2O3 | NaAlO2 | Al(OH)3 |
A. A B. B C. C D. D